
题目列表(包括答案和解析)
|
向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3∶1,其原因可能是: | |
| [ ] | |
A. |
两溶液的体积相同,酸是多元强酸 |
B. |
酸为一元强酸,酸溶液的体积是碱溶液体积的3倍 |
C. |
两溶液的体积相同,酸是弱酸 |
D. |
酸是强酸,且酸溶液的浓度比NaOH溶液浓度大 |
|
向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比大于1∶3,其原因可能是 | |
A. |
两溶液的体积相同,酸是多元强酸 |
B. |
酸溶液的体积可能是碱溶液体积的3倍 |
C. |
两溶液的体积相同,酸是弱酸 |
D. |
酸是强酸,且酸溶液的浓度比NaOH溶液浓度大 |
|
向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3∶1其原因可能是 | |
| [ ] | |
A. |
两溶液的体积相同,酸是多元强酸 |
B. |
若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍 |
C. |
两溶液的体积相同,酸是弱酸 |
D. |
酸是强酸,且酸溶液的浓度比NaOH溶液浓度大 |
|
向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3:1其原因可能是 | |
| [ ] | |
A. |
两溶液的体积相同,酸是多元强酸 |
B. |
若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍 |
C. |
两溶液的体积相同,酸是弱酸 |
D. |
酸是强酸,且酸溶液的浓度比NaOH溶液浓度大 |
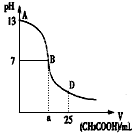
 CH3COO-+H+。
CH3COO-+H+。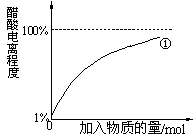

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com