
题目列表(包括答案和解析)
(6分)将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。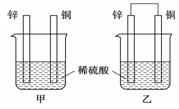
(1)以下叙述中,正确的是 (填标号)。
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
(6分).将Fe粉、Cu粉、FeCl3溶液、FeCl2溶液和CuCl2溶液,混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有 ▲ 。
(2)若氯化铜有剩余,则容器中可能有 ▲ 或 ▲ 。
(3)若氯化铁和氯化铜都有剩余,则容器中不可能有 ▲ ,一定有 ▲ 。
(4)若氯化铁有剩余,则容器中不可能有 ▲ 。
(10分)用“√”或“×”判断下列说法是否正确。
(1)一个D2O分子所含的中子数为8。
(2)HI、HBr、HCl、HF的稳定性依次增强。
(3)同主族元素从上到下,单质的熔点逐渐降低。
(4)常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
(5)从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
(6)将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
(7)在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
(8)二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
(9)用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
(10)苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
(10分)用“√”或“×”判断下列说法是否正确。
(1)一个D2O分子所含的中子数为8。
(2)HI、HBr、HCl、HF的稳定性依次增强。
(3)同主族元素从上到下,单质的熔点逐渐降低。
(4)常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快。
(5)从能量角度看,断开化学键要放热,形成化学键要吸热。一个化学反应是释放能量,还是吸收能量,取决于二者的相对大小。
(6)将锌片和铜片用导线连接,并平行插入稀硫酸中,由于锌片是负极,所以溶液中的H+向负极迁移。
(7)在二氧化硫与氧气的反应中,适当提高氧气浓度,可提高二氧化硫的转化率。
(8)二氯甲烷没有同分异构体,证明甲烷分子具有正四面体结构。
(9)用点燃或通入酸性高锰酸钾溶液中的方法均可以鉴别甲烷和乙烯。
(10)苯不与酸性高锰酸钾溶液、溴水发生反应,证明苯不具有类似乙烯中的双键。
(6分).将Fe粉、Cu粉、FeCl3溶液、FeCl2溶液和CuCl2溶液,混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有 ▲ 。
(2)若氯化铜有剩余,则容器中可能有 ▲ 或 ▲ 。
(3)若氯化铁和氯化铜都有剩余,则容器中不可能有 ▲ ,一定有 ▲ 。
(4)若氯化铁有剩余,则容器中不可能有 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com