
题目列表(包括答案和解析)
| 实验操作 | 实验现象 | |
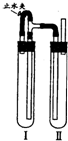
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份. | 有少量气泡产生,溶液的黄绿色褪去. |
| 步骤2 | 将第一份滤液与稀盐酸混合. | 产生大量气泡. |
| 步骤3 | 将第二份滤液加热. | 溶液变浑浊,且有大量无色气体产生. |
 Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是
Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是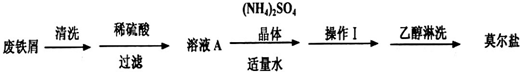

(14分)(1)向1 L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为 ,AlCl3的物质的量 。
(2)已知:2Fe3++2I- = 2Fe2++ I2; 2Fe2++Br2 = 2Fe3++2Br-
①向含有1mol FeI2和1.5mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是 。
②如果向①的溶液中通入3mol Cl2,则被氧化的离子对应的氧化产物分别是 。
(3)①若m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m : n =" 1" : 2.7, 该反应的化学方程式为 __________________________________________________(假设还原产物只有一种,且只生成一种盐)
②若含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4 gHNO3被还原成NO(无其它还原产物)则 n 的范围为_________________________
③某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是____________
(14分)FeSO4·7H2O广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图。根据题意完成下列填空:

(1)铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,操作目的是_____,浸泡后,用____(填操作方法)分离并洗涤铁屑。
(2)操作a为_______________。
(3)最后得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;
②____________________。
(4) FeSO4·7H2O是某些补血剂的主要成分,实验室要测定某补血剂中铁元素的含量。
I.方案一:可用KMn04溶液进行氧化还原滴定。在配制100mL 1.00 × 10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还有___________(填仪器名称)。在配制过程中,下列说法正确的是____________(填序号字母)。
A.KMnO4溶于水不放热,可以直接在容量瓶中溶解
B.容量瓶洗涤后不需干燥即可直接用于实验
C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平
D.如果定容时加水超过刻度线必须毓配制
II.方案二:将FeSO4·7H2O最终转化为Fe2O3,测定质量变化,操作流程如下:
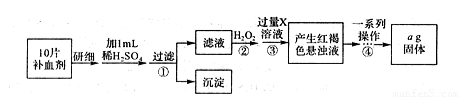
①步骤④中一系列操作依次是:过滤、洗涤、______、冷却、称量。
②假设实验过程中Fe无损耗,则每片补血剂含铁元素的质量______g(用含a的代数式表示)。
③若步骤③加入X溶液的量不足,则最后测出每片补血剂含铁元素的质量将______(填“偏大,’.“偏小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com