通常情况下空气中CO
2的体积分数为0.030%,当空气中CO
2的体积分数超过0.050%时,会引起明显的温室效应.为减小和消除CO
2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO
2创新利用的研究.
(1)目前,用超临界CO
2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于
保护臭氧层
保护臭氧层
.
(2)利用二氧化碳制造全降解塑料,可以缓解温室效应.已知过氧键(-O-O-)不稳定,请写出环氧乙烷与CO
2通过加聚制造全降解塑料的化学方程式:
.
(3)CCTV《科技博览》报道:2004年3月中科院首创用CO
2合成可降解塑料聚二氧化碳(CO
2)
n.下列相关说法合理的是
A
A
.
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同分异构体
C.聚二氧化碳塑料与干冰都是纯净物
D.聚二氧化碳塑料的使用会产生白色污染
(4)最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO
2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:

①分解池中反应的化学方程式为
.
②在合成塔中,若有4.4kgCO
2与足量H
2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程
CO
2(g)+3H
2(g)
CH
3OH(g)+H
2O(g)△H=-49.47kJ?mol
-1CO
2(g)+3H
2(g)
CH
3OH(g)+H
2O(g)△H=-49.47kJ?mol
-1.
(5)小李同学拟用沉淀法测定空气中CO
2的体积分数,为了提高测量的精确度,小李应该选用的试剂为
B或D
B或D
(填序号).
A.Ca(OH)
2 B.Ba(OH)
2 C.BaCl
2 D. BaCl
2和NaOH.

 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1  2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1 


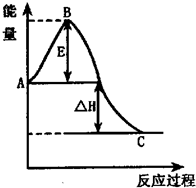 (2010?南昌一模)在恒温恒容的密闭容器中通入1molN2和XmolH2,发生如下反应:N2(g)+3H2(g)
(2010?南昌一模)在恒温恒容的密闭容器中通入1molN2和XmolH2,发生如下反应:N2(g)+3H2(g)