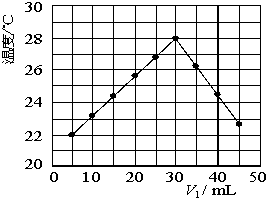
某研究小组将V
1 mL 1.0mol/L HCl溶液和V
2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V
1+V
2=50mL).回答下列问题:
(1)研究小组做该实验时环境温度
低于
低于
(填“高于”、“低于”或“等于”)22℃,判断的依据是
从图型起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃
从图型起点可知:5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,则溶液混合前的实验环境温度一定低于22℃
.
(2)由题干及图形可知,V
1/V
2=
时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为
1.5
1.5
mol/L.
(3)若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学方程式:
H
+(aq)+OH
-(aq)=H
2O (l)△H=-
kJ?mol
-1或HCl(aq)+NaOH(aq)=NaCl(aq)+H
2O (l)△H=-
kJ?mol
-1H
+(aq)+OH
-(aq)=H
2O (l)△H=-
kJ?mol
-1或HCl(aq)+NaOH(aq)=NaCl(aq)+H
2O (l)△H=-
kJ?mol
-1.

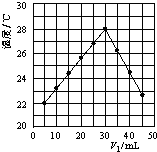 将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )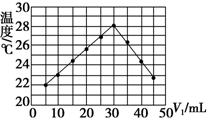 将V1 mL 1.00mol?L-1 盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列说法正确的是( )
将V1 mL 1.00mol?L-1 盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列说法正确的是( ) 某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题:
某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL).回答下列问题: 某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:
某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题: 将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )