
题目列表(包括答案和解析)
 2NH3,在一定条件下已达到平衡状态.
2NH3,在一定条件下已达到平衡状态. 2NH3(g)△H=-92.4KJ/mol
2NH3(g)△H=-92.4KJ/mol 2NH3(g)△H=-92.4KJ/mol
2NH3(g)△H=-92.4KJ/mol| 2-a |
| 2 |
| 2-a |
| 2 |
| 6-3a |
| 2 |
| 6-3a |
| 2 |
500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如右图所示,分析图像完成下列填空:
(1)0—10分钟,N2的平均反应速率为 ___________mol·L-1·min-1, 0—10分钟与10到20分钟两个时间段中,N2的反应速率之比为_________。反应在第10min可能改变的条件是____________,运用图像信息说明该条件不是升温的原因是____________。
(2)计算500℃时,反应N2+3H2 ![]() 2NH3的平衡常数K的数值为_____________。保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将_______(填“增大”或“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态_____(填“大”或“小”或“不变”)。
2NH3的平衡常数K的数值为_____________。保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将_______(填“增大”或“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态_____(填“大”或“小”或“不变”)。
(3)在图中画出25min—40min时间段内N2的物质的量的变化图像。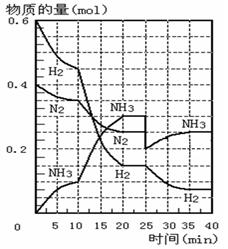
500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如右图所示,分析图像完成下列填空:
(1)0—10分钟,N2的平均反应速率为 ___________mol·L-1·min-1, 0—10分钟与10到20分钟两个时间段中,N2的反应速率之比为_________。反应在第10min可能改变的条件是____________,运用图像信息说明该条件不是升温的原因是____________。
(2)计算500℃时,反应N2+3H2![]() 2NH3的平衡常数K的数值为_____________。保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将_______(填“增大”或“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态_____(填“大”或“小”或“不变”)。
2NH3的平衡常数K的数值为_____________。保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将_______(填“增大”或“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态_____(填“大”或“小”或“不变”)。
(3)在图中画出25min—40min时间段内N2的物质的量的变化图像。
500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如右图所示,分析图像完成下列填空:
(1)0—10分钟,N2的平均反应速率为 ___________mol·L-1·min-1, 0—10分钟与10到20分钟两个时间段中,N2的反应速率之比为_________。反应在第10min可能改变的条件是____________,运用图像信息说明该条件不是升温的原因是____________。
(2)计算500℃时,反应N2+3H2
 2NH3的平衡常数K的数值为_____________。保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将_______(填“增大”或“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态_____(填“大”或“小”或“不变”)。
2NH3的平衡常数K的数值为_____________。保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将_______(填“增大”或“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态_____(填“大”或“小”或“不变”)。
(3)在图中画出25min—40min时间段内N2的物质的量的变化图像。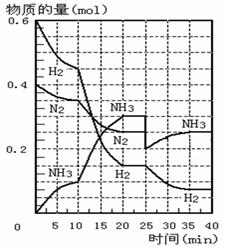
 2NH3的平衡常数K的数值为______.保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将______(填“增大”或“减小”或“不变”).保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态______(填“大”或“小”或“不变”).
2NH3的平衡常数K的数值为______.保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将______(填“增大”或“减小”或“不变”).保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态______(填“大”或“小”或“不变”).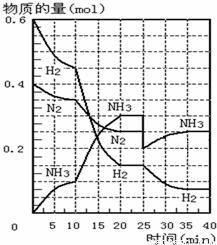
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com