
题目列表(包括答案和解析)
(13分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B—少一个电子层,B原子得一个电子填入3p轨道后, 3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2—离子数之比为2:1。请回答下列问题:
(1)A元素形成的晶体属于密置堆积方式,则其晶体晶胞类型属于 。(填写“六方”、“面心立方”或“体心立方”)。
(2)B—的电子排布式 ,在CB3分子中C元素原子的原子轨道发生的是_______杂化。
(3)C的氢化物空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”,“<”或“=”);用一个化学方程
式说明B、D两元素形成的单质的氧化性强弱: 。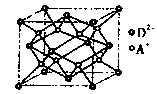
(5)如上图所示是R形成的晶体的晶胞,设晶胞的边
长为acm。则R晶体的密度为 。(阿伏加德数常数用NA表示)
下列叙述中,错误的是( )
| A.阿伏加德罗常数的符号为NA,其近似值为6.02×1023 mol-1 |
| B.等物质的量的O2与O3,所含氧原子数相同 |
| C.在0.5 mol Na2SO4中,含有的Na+数约是6.02×1023 |
| D.摩尔是物质的量的单位 |
下列叙述正确的是
A.氯化铝溶液中加入过量氨水的反应实质是:Al3+ + 3NH3·H2O === Al (OH)3↓ + 3NH4+
B.常温常压下,22.4L乙烯中含C—H键的数目为4NA (NA表示阿伏加德罗常数的值)
C.加入KSCN溶液显红色的溶液中,Na+、Ca2+、HCO3-、I- 可以大量共存
D.标准状况下,2.24 L NH3溶于1L水中制得氨水,则c(NH3·H2O)=0.1mol·L-1
(13分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B—少一个电子层,B原子得一个电子填入3p轨道后, 3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2—离子数之比为2:1。请回答下列问题:
(1)A元素形成的晶体属于密置堆积方式,则其晶体晶胞类型属于 。(填写“六方”、“面心立方”或“体心立方”)。
(2)B—的电子排布式 ,在CB3分子中C元素原子的原子轨道发生的是_______杂化。
(3)C的氢化物空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”,“<”或“=”);用一个化学方程
式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如上图所示是R形成的晶体的晶胞,设晶胞的边
长为acm。则R晶体的密度为 。(阿伏加德数常数用NA表示)
下列叙述中,错误的是( )
A.阿伏加德罗常数的符号为NA,其近似值为6.02×1023 mol-1
B.等物质的量的O2与O3,所含氧原子数相同
C.在0.5 mol Na2SO4中,含有的Na+数约是6.02×1023
D.摩尔是物质的量的单位
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com