太阳能光伏发电最关键的材料是高纯硅.
①Si(粗)+2Cl
2SiCl
4②SiCl
4+2H
2Si(纯)+4M
纯硅是通过以下过程制取的:
纯净的无色透明的硅的氧化物(SiO
2).晶体就是通常所说的水晶,这也许你不熟悉,但说起沙子,你一定不会陌生,沙子的主要成份即是SiO
2.请根据以上信息,回答以下问题:
(1)硅原子的结构示意图为:

X的值为
14
14
;反应②中M的化学式为
HCl
HCl
.
(2)推断SiO
2的物理性质(两点即可)
无色
无色
、
透明
透明
.
(3)沙子和熟石灰加水搅拌成石灰沙浆,用来砌墙很牢固.原因除熟石灰和细沙里的SiO
2发生反应外,还有熟石灰沙浆表面迅速硬化,表面迅速硬化的主要原因(用化学方程式表示).
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
(4)硅烷 (化学式为SiH
4)和甲烷都有可燃性,有科学家认为硅烷可作为未来新能源,与化石能源相比,硅烷燃烧没有二氧化碳排放,你认为硅烷能源的优点是
有助于减缓温室效应
有助于减缓温室效应
(写一点)
(5)钙元素对人类生命和生活具有重要意义
①氧化钙能与水反应,此反应可用于
ABC
ABC
(填字母序号).
A.吸收水分 B.制熟石灰 C.加热食物
②熟石灰的化学式为
Ca(OH)2
Ca(OH)2
,它可用于制备补碘剂Ca(IO
3)
2,其中碘元素的化合价为
+5
+5
.
(6)化学上将只要有元素的化合价发生了变化的化学反应就叫做氧化还原反应,氧化还原反应中含有化合价升高了的元素的反应物叫还原剂,反应①中的还原剂是(写化学式)
Si
Si
.

 SiCl4
SiCl4 Si(纯)+4M
Si(纯)+4M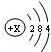 X的值为______;反应②中M的化学式为______.
X的值为______;反应②中M的化学式为______. X的值为
X的值为