
题目列表(包括答案和解析)
A.NH4H与H2O反应时,所得溶液因NH![]() 的水解而呈现酸性
的水解而呈现酸性
B.NH4H与H2O反应中,NH![]() 是氧化剂,H2O是还原剂
是氧化剂,H2O是还原剂
C.NH4H晶体中,铵离子具有正四面体结构,氢离子则是有一对电子的阴离子
D.NH4H固体放入水中后,除了有H2产生,还会同时有NH3产生,且NH3是还原产物
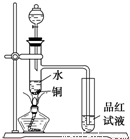
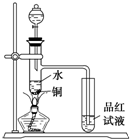 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证: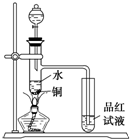
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com