
题目列表(包括答案和解析)
A.分别和盐酸反应时,混合物消耗的盐酸量大
B.分别与足量盐酸反应时,混合物放出的CO2多
C.分别配制等体积的溶液,混合物的物质的量浓度大
D.分别配制等体积溶液,混合物的c(Na+)大
A.分别和盐酸反应时,混合物消耗的盐酸量大
B.分别与足量盐酸反应时,混合物放出的CO2多
C.分别配制等体积的溶液,混合物的物质的量浓度大
D.分别配制等体积溶液,混合物的c(Na+)大
硫铁矿又称黄铁矿(主要成分FeS2,杂质不含硫元素),是地壳中分布最广的硫化物。因其浅黄的颜色和明亮的金属光泽,常被误认为是黄金,故又称“愚人金”。
工业上硫铁矿主要用于接触法制造硫酸,其反应原理为:
①FeS2与O2高温下反应生成SO2;
②SO2在催化剂作用下与O2反应生成SO3;
③SO3与H2O反应生成H2SO4.
(1)若1.00吨 SO2与O2的混合气体中含SO2 0.40吨,在一定条件下发生反应②,有80%的SO2发生转化,则反应后混合气体中SO3的质量分数是_________。
(2)现用80吨硫铁矿制硫酸,最后生产出100吨98%的硫酸。若反应过程中硫元素的损失率为5%,则硫铁矿中FeS2的质量分数为__________________。
(3)在浓硫酸中继续溶解SO3后所形成的液体称发烟硫酸,其浓度通常以游离的SO3含量来表示,如20%的发烟硫酸即表示在硫酸中含有20%的SO3。现有1L含SO330%的发烟硫酸(密度为1.95g/cm3),要把它稀释成质量分数为95%的浓硫酸,需加水约多少?(写出计算过程)
(4)已知:850℃~900℃时,硫铁矿在氧气中煅烧,可能发生下列反应:
①3FeS2+8O2→Fe3O4+6SO2
②4FeS2+11O2→2Fe2O3+8SO2
为使FeS2煅烧完全生成Fe2O3,工业上使用过量氧气,当氧气过量20%时,求所得炉气中SO2的体积分数。(写出计算过程)
57.将480 g纯净的FeS2在氧气中完全反应,若所得固体中n(Fe)∶n(O)=4∶a,此时消耗氧气b mol,试写出b与a的关系式_______________________。
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。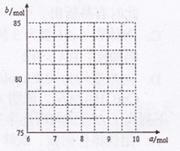
已知:①550℃时,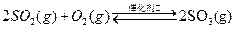
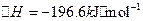
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中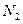 与
与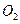 的体积
的体积
比为4:1):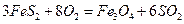 ,
,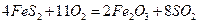
(1) 550℃时,6.4 g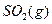 与足量
与足量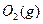 充分反应生成
充分反应生成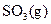 ,放出热量
,放出热量
9.83 kJ
(填“大于”、“等于”或“小于”)o
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
a.向平衡混合物中充入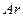 b.向平衡混合物中充入
b.向平衡混合物中充入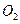
c.改变反应的催化剂 d.降低反应的温度
(3)为使 完全生成
完全生成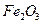 ,生产时要使用过量的
,生产时要使用过量的
空气,则当空气过量50%时,所得炉气中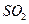 的
的
体积分数是多少?
(4)720 g纯净的 在空气中完全煅烧,所得固体
在空气中完全煅烧,所得固体
中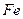 和
和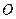 的物质的量之比n(
的物质的量之比n(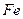 ):n(
):n(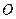 )="6:"
)="6:"  ,
,
此时消耗空气为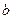 mol。
mol。
①试写出易与口的关系式: 。
②请在右图中画出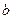 与
与 的关系曲线。
的关系曲线。
(10分)、硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~900℃时,硫铁矿在纯净的氧气中煅烧,可能发生下列反应:
① 3FeS2+8O2→Fe3O4+6SO2 ② 4FeS2+11O2→2Fe2O3+8SO2
⑴为使FeS2煅烧完全生成Fe2O3,使用过量氧气,当氧气过量20%时,求所得炉气中SO2的体积分数。(写出计算过程)
⑵480 g纯净的FeS2在氧气中完全反应,若所得固体中,Fe和O的物质的量之比
n(Fe)∶n(O)=4∶a,此时消耗氧气b mol。
①试写出b与a的关系式:_______ ______。
② b的最大值为 ____,最小值为_______ ____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com