
题目列表(包括答案和解析)
(8分)"比较"是化学研究物质性质的基本方法之一,请运用比较法解答下列问题.已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧 化物反应。
化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
(2)当1molSO3参加反应时,转移电子的物质的量为 mol。
(3)通过比较可知:在氧化物中,当非金属元素处于  价时,其氧化物与过氧化钠反应就有O2生成。
价时,其氧化物与过氧化钠反应就有O2生成。
(8分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)="2NO(g) " △H=+180.5kJ/mol
N2(g)+3H2(g )
) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)==4NO(g)+6H2O(g);△H= kJ/mol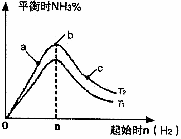
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)
 2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T1和T2的关系是:T1_______T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是________(填字母).
(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数。(写出计算过程,结果保留小数点后一位)
(8分)目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。
(1)下列说法不正确的是
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。A为 离子交换膜、B为 离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在 区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到 。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
(8分)根据下图提供的仪器装置,完成提纯并测定Na2CO3样品纯度(其中只含NaHCO3杂质)的实验。
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 仪 器 及 装 置 |  |  |  |  |  |  |  |
 CO3样品中的NaHCO3分解放出的二氧化碳的体积。
CO3样品中的NaHCO3分解放出的二氧化碳的体积。(8分)"比较"是化学研究物质性质的基本方法之一,请运用比较法解答下列问题.已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
(2)当1molSO3参加反应时,转移电子的物质的量为 mol。
(3)通过比较可知:在氧化物中,当非金属元素处于 价时,其氧化物与过氧化钠反应就有O2 生成。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com