
题目列表(包括答案和解析)
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
| ||
| ||
小明等同学为了探究酸、碱、盐溶液的导电性,设计了如下实验:
1.在5只250mL烧杯分别加入浓度均为0.1mol·L-1的盐酸、CH3COOH溶液、NaOH溶液、NaCl溶液、氨水各150mL。
2.在5种溶液中分别放入相同规格的石墨电极,按下图连接好。

3.接通电源,仔细观察现象。
现象1:五个灯泡都亮起来。
结论: 。
现象2:盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,醋酸、氨水对应的灯泡较暗。
结论: 。
思考:
1.酸、碱、盐溶液导电与金属导电的原理是否相同,为什么?
2.同学们为了探究不同电解质之间电离能力的差异,设计了上述实验,通过观察灯泡的明亮程度,判断电解质的电离能力大小,为此必须控制其他能影响灯泡亮度的一些因素,使之保持一致,从而不影响灯泡的明亮程度。在本实验中,采取了哪些主要措施来控制其他因素对灯泡亮度的影响?(写出三条即可) 。
3.小明同学根据现象2得出一个结论:氯化氢、氯化钠、氢氧化钠是强电解质,醋酸、一水合氨是弱电解质。你同意他这个观点吗?为什么?
。
4.为了进一步探究氯化氢等化合物是强电解质,小红同学在老师的帮助下测定了0.1mol·L-1的盐酸中的氢离子浓度,通过对结果的分析,即可得出结论。说明氯化氢是强电解质的理由是:测得溶液中的氢离子浓度 0.1mol·L-1(选填>、<、=)。
5.同学们在实验的基础上,进一步查阅资料得知:一般来说, 是强电解质, 是弱电解质。根据以上结论推测:如果将上述实验中的醋酸和氨水混匀,然后分别盛放在原来的烧杯中。接通电源,可以观察到的现象是:
A.与混合前无任何区别。
B.5只灯泡都亮起来,亮度完全相同。
C.只有盐酸、氯化钠、氢氧化钠溶液对应的灯泡亮起来,另外两只不亮。
D.5个灯泡都亮起来,盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,另外两只略暗,但明显比混合前明亮。
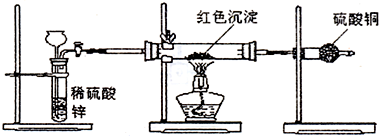
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象
(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。
浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液及电极均相同,两杯溶液的温度不同,可否形成原电池
3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池 :表1
| 甲杯硫酸铜浓度 mol/L | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 |
| 乙杯硫酸铜浓度 mol/L | 0.8 | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 |
| 两杯溶液浓度差值 | 0 | 0.4 | 0.6 | 0.7 | 0.75 | 0.775 |
| 电压 mV | 0 | 6 | 12 | 16 | 22 | 26 |
| 电流 mA | 0 | 0.02 | 0.04 | 0.06 | 0.07 | 0.08 |
实验B:温差电池:表2
| 甲杯硫酸铜温度℃ | 19 | 19 | 19 | 19 | 19 | 19 |
| 乙杯硫酸铜温度℃ | 19 | 29 | 39 | 49 | 59 | 69 |
| 两杯溶液温差℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 电压 mV | 0 | 6.1 | 12 | 20 | 27 | 34 |
| 电流 mA | 0 | 0.025 | 0.047 | 0.07 | 0.15 | 0.18 |
五、【讨论】
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表面有铜析出。
这说明:甲杯中的电极反应式为
乙杯中的电极反应式为
电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |


 及电极均相同,两杯溶液的温度不同,可否形成原电池
及电极均相同,两杯溶液的温度不同,可否形成原电池| 甲杯硫酸铜浓度 mol/L | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 |
| 乙杯硫酸铜浓度 mol/L | 0.8 | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 |
| 两杯溶液浓度差值 | 0 | 0.4 | 0.6 | 0.7 | 0.75 | 0.775 |
| 电压 mV | 0 | 6 | 12 | 16 | 22 | 26 |
电流 mA mA | 0 | 0.02 | 0.04 | 0.06 | 0.07 | 0.08 |
| 甲杯硫酸铜温度℃ | 19 | 19 | 19 | 19 | 19 | 19 |
| 乙杯硫酸铜温度℃ | 19 | 29 | 39 | 49 | 59 | 69 |
| 两杯溶液温差℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 电压 mV | 0 | 6.1 | 12 | 20 | 27 | 34 |
| 电流 mA | 0 | 0.025 | 0.047 | 0.07 | 0.15 | 0.18 |
 面有铜析出。
面有铜析出。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com