
题目列表(包括答案和解析)
根据以下化学反应方程式回答问题:
(1)已知反应3S+6KOH![]() 2K2S+K2SO3+3H2O,①还原剂________,还原产物________.
2K2S+K2SO3+3H2O,①还原剂________,还原产物________.
②请用双线桥法标明上述化学方程式中电子转移的方向和数目________.
(2)已知反应KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,
①当有1 mol I2生成时,有________mol还原剂被氧化.
②当有1 mol氧化剂参与反应时,转移电子的物质的量为________mol.
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2

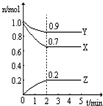
 2Z
2Z 2Z
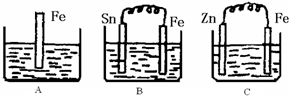
2Z 根据所学化学反应原理,解决以下问题:
根据所学化学反应原理,解决以下问题:| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
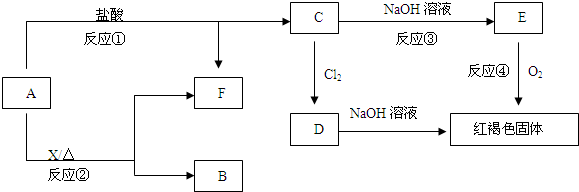
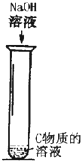 类反应的名称是
类反应的名称是湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com