
题目列表(包括答案和解析)
|
某同学设计一个如图所示(用铅蓄电池做电源)的电化学实验.下列说法正确的是
| |
| [ ] | |
A. |
电解池的阳极电极反应式:Fe-2e-=Fe2+ |
B. |
电解池的阴极电极反应式:2H++2e-=H2↑ |
C. |
铅蓄电池的负极的电极反应式:PbO2+4H++SO42-+2e-=PbSO4+2H2O |
D. |
铅蓄电池的负极的电极反应式:Pb-2e-=Pb2+ |
某同学设计一个如图所示(用铅蓄电池做电源)的电化学实验。下列说法正确的是( )
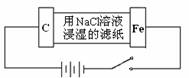
A.电解池的阳极电极反应式:Fe-2e-=Fe2+
B.电解池的阴极电极反应式:2H++2e-=H2↑
C.铅蓄电池的负极的电极反应式:PbO2+4H++SO42-+2e-=PbSO4+2H2O
D.铅蓄电池的负极的电极反应式:Pb-2e-=Pb2+
欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去.
转化为Cr(OH)3沉淀除去.
已知:

(1)某含铬废水处理的主要流程如图所示:
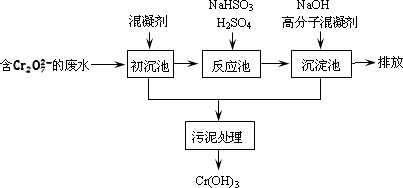
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·24H2O,用离子方程式表示其反应原理是________.
②反应池中发生主要反应的离子方程式是Cr2O![]() +3HSO
+3HSO![]() +5H+=2Cr3++3SO
+5H+=2Cr3++3SO![]() +4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是________、________.证明Cr3+沉淀完全的方法是________________.
+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是________、________.证明Cr3+沉淀完全的方法是________________.
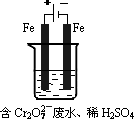
(2)工业可用电解法来处理含Cr2O![]() 废水.实验室利用如图模拟处理含Cr2O
废水.实验室利用如图模拟处理含Cr2O![]() 的废水,阳极反应式是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑.Fe2+与酸性溶液中的Cr2O
的废水,阳极反应式是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑.Fe2+与酸性溶液中的Cr2O![]() 反应的离子方程式是________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________.用电解法处理该溶液中0.01 mol Cr2O
反应的离子方程式是________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________.用电解法处理该溶液中0.01 mol Cr2O![]() 时,至少得到沉淀的质量是________g.
时,至少得到沉淀的质量是________g.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com