
题目列表(包括答案和解析)
现有几种物质的熔点数据如下表:
A组 B组 C组 D组
金刚石:3550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅1723 ℃ Rb:39 ℃ Hi:-51 ℃ CsCl:645 ℃
据此完成下列问题:
(1)A组属于__________晶体,其熔化时克服的粒子间的作用力是__________。
(2)B组晶体共同的物理性质是__________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于____________________。
(4)D组晶体可能具有的性质是__________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为Na mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为 __________
g·mol-1。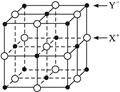
A组 | B组 | C组 | D组 |
金刚石:3550 ℃ | Li:181 ℃ | HF:-83 ℃ | NaCl:801 ℃ |
硅晶体:1410 ℃ | Na:98 ℃ | HCl:-115 ℃ | KCl:776 ℃ |
硼晶体:2300 ℃ | K:64 ℃ | HBr:-89 ℃ | RbCl:718 ℃ |
二氧化硅1723 ℃ | Rb:39 ℃ | Hi:-51 ℃ | CsCl:645 ℃ |
据此完成下列问题:
(1)A组属于__________晶体,其熔化时克服的粒子间的作用力是__________。
(2)B组晶体共同的物理性质是__________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性?
(3)C组中HF熔点反常是由于____________________。
(4)D组晶体可能具有的性质是__________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
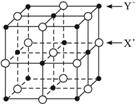
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为NA mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为__________g·mol-1。
已知X、Y、Z、L四种元素是组成蛋白质的基础元素且原子序数依次增大.回答下列问题:
1.L的元素符号为________;Y元素原子核外电子中,未成对电子数与成对电子数之比为________;四种元素的原子半径从大到小的顺序是________(用元素符号表示).
2.Z、X两元素按原子数目比1∶3可构成分子A,A的电子式为________;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物.已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5%,且该分子结构中只有单键.则B的结构式为________.若64 g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000 kJ的热量,写出该反应的热化学方程式________.
3.硒(Se)是人体必需的微量元素,与元素L同一主族,该族第2~5周期元素单质分别与H2反应生成l mol气态氢化物产生的热量数据如下,其中能表示生成1 mol硒化氢所产生的热量的是________(选填字母编号).
a.-99.7 kJ
b.-29.7 kJ
c.+20.6 kJ
d.+241.8 kJ
X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;

(1)X位于元素周期表第________族.X的一种单质熔点很高,硬度很大,则这种单质的晶体属于________晶体.
(2)X与Y中电负性较强的是(填元素符号)________;XY2的电子式是________,分子中存在________个σ键.
(3)Z2Y2中含有的化学键类型有________.阴、阳离子的个数比为________.
(4)W的基态原子核外电子排布式是________.
(5)废旧印刷电路板上有W的单质A.用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A.已知:
A(s)+H2SO4(aq)![]() ASO4(aq)+H2(g) ΔH=+64.4 kJ·mol-1
ASO4(aq)+H2(g) ΔH=+64.4 kJ·mol-1
2H2O2(l)![]() 2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1
2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1
H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH= -285.8 kJ·mol-1
H2O(l) ΔH= -285.8 kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):________.
硫元素价态众多,可与卤素、氮等元素化合形成许多复杂化合物,在科学技术和生成中有重要的应用.根据题意完成下列计算:
1.由硫与限量氯气在50~60℃反应16~20小时,可恰好完全反应,得到两种硫的氯化物A和B.A物质中的含硫量为0.131,B物质中的含氯量为0.816,A的相对分子质量比B大71.计算确定这两种氯化物的分子式分别为________.
若上述反应得到的A、B的物质的量比为3:2,则参加反应的S和氯气的物质的量之比为________.
2.硫的卤化物或卤氧化物都有强水解性,可以作脱水剂.SF4吸收V mL液态水(4℃),完全反应,得到3.2 g SO2气体(假设SO2完全逸出)和10%的酸溶液,计算吸收的液态水的体积V为________mL.
3.S4N4是亮橙色固体,不溶于水和有机溶剂,是一种重要的金属有机化学反应物.一般用S2Cl2、SCl2的惰性溶剂(CS2)氨解制得:
6S2Cl2+16NH3→S4N4+S8+12NH4Cl;
24SCl2+64NH3→4S4N4+S8+48NH4Cl.
S2Cl2、SCl2的混合液体52.86 g溶于足量的CS2中,再通入35.84 L氨气(标准状况)完全氨解,产生14.080 g硫单质.剩余氨气用40 g水完全吸收形成氨水(密度为0.923 g/mL).
计算:①该混合液体中S2Cl2、SCl2的物质的量之比为________.
②所得氨水的物质的量浓度为________(保留1位小数).
4.S4N4与Ag在一定条件下反应,失去N2而缩合成(SN)x,(SN)x合成于1910年,过了五十年,才发现它在0.26 K的低温下,可转变为超导体(superconductor).(SN)x的结构式为:

已知1.20×105 mol S4N4与Ag发生缩合,失去了1.20×105 mol N2,生成二百聚物[(SN)200]和三百聚物.测得缩合产物中二百聚物的质量分数为0.50.
计算:①缩合产物中各缩合物的物质的量.
②若Ag的实际使用量为8.64 kg,求Ag的循环使用次数.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com