
题目列表(包括答案和解析)

 关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高.观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系.?请回答下列问题:
关于“电解氯化铜溶液时的pH变化”问题,化学界有以下两种不同的观点:观点一是:“理论派”认为电解氯化铜溶液后溶液的pH升高.观点二是:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时pH的变化如图曲线的关系.?请回答下列问题:| 水解 |
| 水解 |
| ||
| ||
| c[Co(H2O)62+]c4(Cl-) |
| c(CoCl2-) |
| c[Co(H2O)62+]c4(Cl-) |
| c(CoCl2-) |
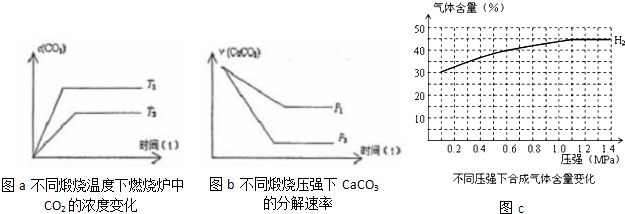
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ?mol-1 ②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ?mol-1 ③CaO(s)+CO2(g)=CaCO3(s) △H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应: ④C(s)+O2(g)=CO2(g) △H=-393.8kJ?mol-1 ⑤CaCO3(s)=CaO(s)+CO2(g) K |

 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 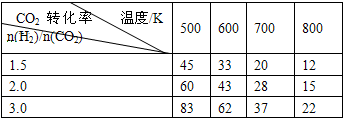

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com