
题目列表(包括答案和解析)
(9分)
Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

(1)从右图实验装置看,其中尚缺少的一种玻璃用品是 ,除此之外,装置中的一个明显错误是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将 ________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视 。
(2)在铁架台上垫一张白纸,其目的是 。
(2)某学生根据3次实验分别记录有关数据如下表:
|
滴定次数 |
待测NaOH溶液的体积/mL |
0.1000 mol/L盐酸的体积/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式并计算该NaOH溶液的物质的量浓度
。
(4)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 。
(9分)
Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题: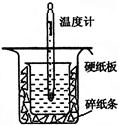
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是 ,除此之外,装置中的一个明显错误是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将 ________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视 。
(2)在铁架台上垫一张白纸,其目的是 。
(2)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
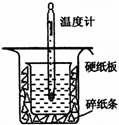
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是 ,除此之外,装置中的一个明显错误是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将 ________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视 。
(2)在铁架台上垫一张白纸,其目的是 。
(2)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式并计算该NaOH溶液的物质的量浓度
。
(4)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 。
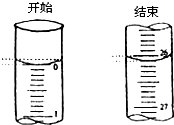 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com