
题目列表(包括答案和解析)
| A.需要加热才能发生的反应一定是吸热反应 |
| B.当反应物的总能量比生成物的总能量高时,为放热反应;当生成物的总能量比反应物的总能量高时,则为吸热反应 |
| C.CO(g)的燃烧热是283.0 kJ?mol-1,则表示CO(g)的燃烧的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=-283.0 kJ?mol-1 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
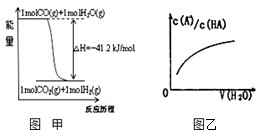 关于下列各图的叙述错误的是( )
关于下列各图的叙述错误的是( )| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2?2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、常温下0.4 mol?L-1 HB溶液和0.2 mol?L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) | ||
| C、常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com