
题目列表(包括答案和解析)
(1)
在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)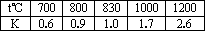
①该反应的化学平衡常数的表达式K=________,由上表数据可得,该反应为________反应.(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01 mol·L-1、c(H2O)=0.03 mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率________(填“大”、“小”或“不能确定”)
③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为________.
(2)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+
CH3OH(g)+
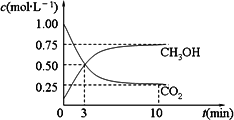
①平衡时CH3OH的体积分数w为________.
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.下列说法正确的是________
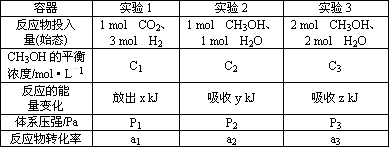
A.2C1>C3
B.x+y=49.0
C.2P2<P3
D.(a1+a3)<1
E.2P1>P3
F.a1=a2
③
在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g)由等物质的量X气体和Y气体组成混合物,在一定条件下发生如下反应:
X(g)+Y(g)![]() nZ(g)
nZ(g)
经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:

(1)该化学反应的正反应方向是________热反应.
(2)t1表示该反应在时间t内可达平衡的________(填“最高”或“最低”)温度
(3)在T<T1的某一温度内,该反应________(填“能”或“不能”)建立平衡
(4)在温度T2时增大压强,达新平衡时,wZ%不将增大,则n的值是________.
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。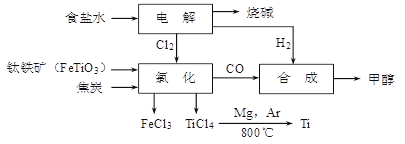
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期,第______族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因: 。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
 (5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
(5)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q???? 184.8kJ(填“>”、“<”或“=”)。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是??????????? 。
a.3v逆(N2)=v正(H2)? ???????? b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 ???? d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
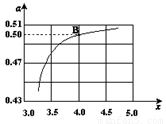
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)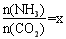 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是?????????? 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是?????????? 。
(3)图中的B点处,NH3的平衡转化率为?????? 。

(4)已知:? 3Cl2+2NH3→N2+6HCl????? ――①?? 3Cl2+8NH3→N2+6NH4Cl??? ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→?????????????????????? ――③
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l)。
CO(NH2)2
(l) + H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→ ――③
(5)反应③中的还原剂是 ,还原产物是 。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com