
题目列表(包括答案和解析)
反应① Fe(s)+CO2(g)===FeO(s)+CO(g);△H1= akJmol-1
反应② CO(g)+1/2O2(g)===CO2(g);△H2= bkJmol-1
测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
(1)反应①的化学平衡常数表达式为 ,a 0(填“>”、“<”或“=”)。 在500℃2L 密闭容器中进行反应①,Fe 和 CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为 ,用CO表示的化学反应速率为 。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900℃ D.使用合适的催化剂
(3)下列图像符合反应①的是 (填序号)(图中v是速率、为混合物中CO的含量,T为温度)。
(4)由反应①和②可求得反应2Fe(s)+O2(g)===2FeO(s) △H3中的△H3= (用含a、b的代数式表示)。
(5)如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
(填“甲醇”或“氧气”),b处电极上发生的电极反应是:
(14分)反应① Fe(s)+CO2(g)===FeO(s)+CO(g);△H1=" a" kJmol-1反应② CO(g)+1/2O2(g)===CO2(g);△H2=" b" kJmol-1测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
(1)反应①的化学平衡常数表达式为 ,a 0(填“>”、“<”或“=”)。在 500℃2L 密闭容器中进行反应①,Fe 和 CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为 ,用CO表示的化学反应速率为 。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有__________(填序号)。
| A.缩小反应容器体积 | B.通入CO2 |
| C.升高温度到900℃ | D.使用合适的催化剂 |

(14分)反应① Fe(s)+CO2(g)===FeO(s)+CO(g);△H1= a kJmol-1反应② CO(g)+1/2O2(g)===CO2(g);△H2= b kJmol-1测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:

(1)反应①的化学平衡常数表达式为 ,a 0(填“>”、“<”或“=”)。 在 500℃2L 密闭容器中进行反应①,Fe 和 CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为 ,用CO表示的化学反应速率为 。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应容器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
(3)由反应①和②可求得反应 2Fe(s)+O2(g)===2FeO(s) △H3中的△H3= (用含a、b的代数式表示)。
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“甲醇”或“氧气”),b处电极上发生的电极反应式:

 C(g)+D(g)过程中的能量变化如图所示,回答下列问题
C(g)+D(g)过程中的能量变化如图所示,回答下列问题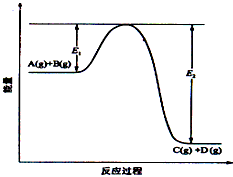

 为混合物中CO的含量,T为温度)。
为混合物中CO的含量,T为温度)。 

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com