
题目列表(包括答案和解析)
(每空2分,共14分)下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
① G是一种红棕色粉末、C既能与盐酸又能与NaOH溶液反应
② I是一种常见的温室气体,它和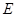 可以发生反应:2E+I
可以发生反应:2E+I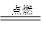 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.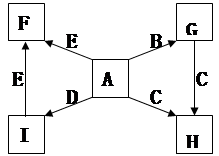
回答问题:
(1)写出G→H的化学方程式为________________________;
此反应在工业上常用于焊接钢轨,实验室在演示该实验时,在装置中加入G、C混合物后,引发此反应的操作是 ;
(2)化合物Ⅰ的电子式为______________________,
(3)用适量的盐酸溶解G后,所得溶液叫蚀铜剂,常用来洗涤印刷电路板上的铜,写出该反应的离子方程式为________________;
(4)E在I中燃烧观察到的现象是_______________________。
(5)在氩气的保护下,将一定计量的C、E加热熔炼可获得一种潜在的贮氢材料E17C12,该材料吸氢的反应方程式为E17C12+17H2 = 17EH2+12C
①熔炼制备贮氢材料E17C12时通入氩气的目的是
②1mol E17C12完全吸氢后,将得到的产物与足量的盐酸完全反应。释放出H2的物质的量为
(14分)
(1)下图中A~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体。已知A是一种不含金属元素的盐,受热分解能得到物质的量相等的三种产物;A加热后生成的混合气体若通过碱石灰,只剩余气体B(B为无色有刺激性气味的气体),若通过浓硫酸则只剩余气体D(D为无色无味气体);C为淡黄色固体。各物质间的转化关系如下图所示:
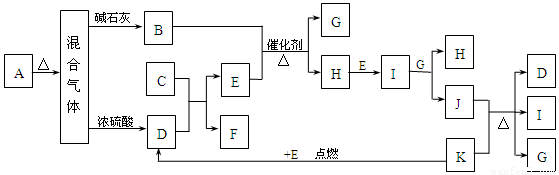
请回答下列问题:
①写出C的电子式: 。
②写出A的溶液与足量NaOH溶液反应的离子方程式:
。
③写出实验室制取B的化学方程式:
。
④写出J与K反应的化学方程:
。
(2)火星探测车在火星大气中检测到了气体M。资料显示,M分子是三原子分子,其相对分子质量为60,在地球环境下M易分解。粉末状的KSCN与95%的硫酸在一定条件下反应可得到气体M和两种硫酸氢盐,生成物的物质的量之比是1﹕1﹕1。则两种硫酸氢盐的化学式为 、 ,气体M的结构式是 。
(共14分)下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,X受热分解所得气体在标况下的体积比为1:1,H为淡黄色粉末,B和G常温下是液体,其余均为气体。根据图中关系推断:
(1)化学式X ;
(2)A的电子式为 ;空间构型 ;
C的结构式为 ;H所包含的化学键类型 。
(3)工业上制取A的化学反应方程式 ;A→D的化学反应方程式 ;
C+H→E的化学反应方程式 ;G→D的离子反应方程式 。
非选择题 【共道小题,分】【14分】下图是实验室验证某铜银合金完全溶解于一定量的浓硝酸时,生成NO2气体中含有NO的实验装置。常温下,NO2与N2O4混合存在,在低于0 ℃时,几乎只有白色N2O4晶体存在。
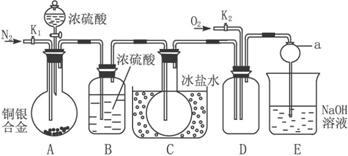
(1)反应前打开A部分的活塞K1,持续通一段时间氮气,其理由是_____________________
_____________________________________________________________________。
(2)若装置中缺B部分,其后果是__________________________________________________。
(3)反应结束后,打开D部分的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热的氧气,则瓶内气体的颜色比前者更深,其原因是__________________________。
(4)E部分中a仪器所起的作用是______________________________________________。
(5)已知该铜银合金的质量为15 g,加入40 mL 135 mol·L-1的浓硝酸,实验结束后,A部分烧瓶内溶液中的c(H+)=1 mol·L-1(假设反应中HNO3既无挥发也无分解,体积仍为40 mL)。
①参加反应硝酸的物质的量为_____________________。
②为测定铜银合金中铜的质量分数,还需要进行的主要实验操作是_____________________。
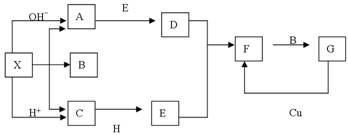
(每空2分,共14分)下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
① G是一种红棕色粉末、C既能与盐酸又能与NaOH溶液反应
② I是一种常见的温室气体,它和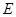 可以发生反应:2E+I
可以发生反应:2E+I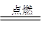 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
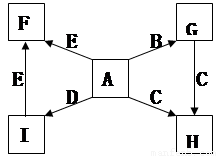
回答问题:
(1)写出G→H的化学方程式为________________________;
此反应在工业上常用于焊接钢轨,实验室在演示该实验时,在装置中加入G、C混合物后,引发此反应的操作是 ;
(2)化合物Ⅰ的电子式为______________________,
(3)用适量的盐酸溶解G后,所得溶液叫蚀铜剂,常用来洗涤印刷电路板上的铜,写出该反应的离子方程式为________________;
(4)E在I中燃烧观察到的现象是_______________________。
(5)在氩气的保护下,将一定计量的C、E加热熔炼可获得一种潜在的贮氢材料E17C12 ,该材料吸氢的反应方程式为E17C12+17H2 = 17EH2+12C
①熔炼制备贮氢材料E17C12时通入氩气的目的是
②1mol E17C12完全吸氢后,将得到的产物与足量的盐酸完全反应。释放出H2的物质的量为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com