氨是一种重要的化工产品.其合成原理为N
2(g)+3H
2(g)?2NH
3(g)△H<0.
(1)已知:N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ?mol
-1;
4NH
3(g)+5O
2(g)═4NO(g)+6H
2O(g)△H=-905kJ?mol
-1 2H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ?mol
-1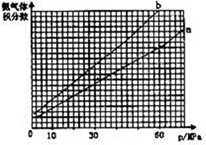
则N
2(g)+3H
2(g)?2NH
3(g)△H=
.
(2)合成氨反应中平衡混合物中氨气的体积分数与压强、温度的关系如图.若曲线a对应的温度为500℃,则曲线b对应的温度可能是
.
A.600℃B.550℃C.500℃D.450℃
(3)合成氨所需的氢气可由甲烷与水反应制备.发生反应为:CH
4(g)+H
2O(g)
CO(g)+3H
2(g);△H>0
在一定温度下,在1L容器中发生上述反应,各物质的物质的量浓度变化如下表:
| t/min |
CH4(mol?L-1) |
H2O(mol?L-1) |
CO(mol?L-1) |
H2(mol?L-1) |
| 0 |
0.2 |
0.3 |
0 |
0 |
| 2 |
n1 |
n2 |
n3 |
0.3 |
| 3 |
n1 |
n2 |
n3 |
0.3 |
| 4 |
0.09 |
0.19 |
x |
0.33 |
①表中x=
mol?L
-1;前2min内CH
4的平均反应速率为
.
②反应在3~4min之间,氢气的物质的量增多的原因可能是
(填代号)
A.充入水蒸汽B.升高温度C.使用催化剂D.充入氢气
(4)已知:
Kw(H2O)=1.0×10-14、Ksp[A1(OH)3]=1.3×10-33、Kb(NH3?H2O)=1.7×10
-5,
NH4++[A1(OH)4]-=A1(OH)3↓+NH3?H2O.向含有等物质的量
NH4+、A13+、H+的混合溶液中慢慢加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,其中:第二个离子反应的离子方程式是
,最后一个离子反应的离子方程式是
.

 2NH3,在一定条件下已达到平衡状态.
2NH3,在一定条件下已达到平衡状态. 2NH3(g)△H=-92.4KJ/mol
2NH3(g)△H=-92.4KJ/mol 2NH3(g)△H=-92.4KJ/mol
2NH3(g)△H=-92.4KJ/mol
 某实验小组拟用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
某实验小组拟用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤: