
题目列表(包括答案和解析)
(每空2分,共18分)在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
|
序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8 0 0 ℃ |
n2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_ 0(填“>、=、<”),理由是_
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示,根据图中所示判断下列说法正确的__ __。
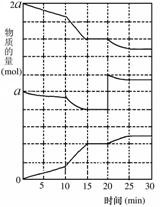
a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。
反应进行并达到平衡后,测得容器内气体压强为P(始)的 。若相同条件下,向上述
容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压
强仍为P(始)的 。
①a、b、c必须满足的关系是 , 。
(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式: 正极: ;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式: 正极: ;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
该反应的反应方程式可表示为 ,平衡时Y气体的转化率 。
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为 ;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量 。
(每空2分 共16分) 20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子; Ⅲ、分子中价层电子对之间的斥力主要顺序为: i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力; ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力; iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强; iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
|
n+m |
2 |
|
|
VSEPR理想模型 |
|
正四面体 |
|
价层电子对之间的理想键角 |
|
109°28′ |
(2)请用VSEPR模型解释CO2为直线型分子的原因 。
(3) H2O分子的立体构型为: ,请你预测水分子中∠H-O-H的大小范围为 ,原因是 。
(4) SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型: 。
(15分)《物质结构与性质》(每空2分,化学反应方程式3分)
Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、4、6,且都含有18个电子,其中B、C是由两种元素的原子组成,且B分子中两种元素原子的个数比均为1 :2 ,C分子中两种元素原子的个数比均为1 :1,D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);分子空间结构为_______型。
(3)C在实验室可用来制取常见的一种气体单质,试写出该化学反应方程式
________________________________________________________________________。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
________________________________________________________________________。
Ⅱ. Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(5)基态Cu原子的核外电子排布式为 。
(6)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com