
题目列表(包括答案和解析)
(12分)(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5千焦热量,其热化学方程式是:
。
又已知:H2O(液)=H2O(气);△H =-44kJ/mol,则11.2升(标准状况下)乙硼烷完全燃烧时生成气态水时放出的热量为 千焦。
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(12分)(1) 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5千焦热量,其热化学方程式是:
。
又已知:H2O(液)=H2O(气);△H =-44kJ/mol,则11.2升(标准状况下)乙硼烷完全燃烧时生成气态水时放出的热量为 千焦。
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态 水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(12分)(1) 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5千焦热量,其热化学方程式是:
。
又已知:H2O(液)=H2O(气);△H =-44kJ/mol,则11.2升(标准状况下)乙硼烷完全燃烧时生成气态水时放出的热量为 千焦。
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
 水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。(15分)写出下列反应的热化学方程式:
(1)已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,写出能表示该反应燃烧热的热化学方程式
(2)NA表示阿伏加德罗常数,在CH4(g)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出445kJ的热量。____________________________________________
(3)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、
c kJ,则N2与H2反应生成NH3的热化学方程式为__________________________________
(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。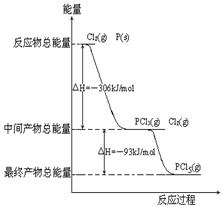
①P和Cl2反应生成PCl3的热化学方程式
②PCl5分解成PCl3和Cl2的热化学方程式_______________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com