
题目列表(包括答案和解析)
在673K、30MPa下,在密闭容器中进行合成氨反应: N2(g)+3H2(g) 2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
| A.正反应速率:a点小于b点 |
| B.c点处反应达到平衡 |
| C.d点和e点处的n(N2)不一样 |
| D.若其他条件不变,在773 K时反应至t1时刻,n(H2)比图中d点对应的n(H2)大 |
 2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是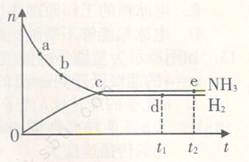
| A.正反应速率:a点小于b点 |
| B.c点处反应达到平衡 |
| C.d点和e点处的n(N2)不一样 |
| D.若其他条件不变,在773 K时反应至t1时刻,n(H2)比图中d点对应的n(H2)大 |
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:
N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol
2NH3(g)+92.4 kJ/mol
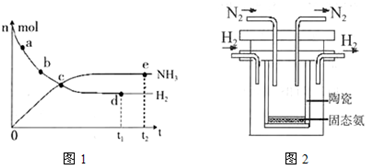
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。

(1)下列叙述正确的是( )
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:_____________。
2NH3(g)的平衡常数值为:_____________。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e 2H+,则阴极的电极反应为:_____________。
2H+,则阴极的电极反应为:_____________。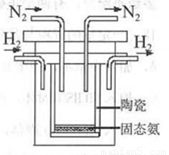
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com