
题目列表(包括答案和解析)
在25℃、101Kpa时,已知:
C(石墨,S)+ O2(g)=CO2(g) △H=-393.51KJ?mol-1
C(金刚石,S)+ O2(g)=CO2(g) △H=-393.41KJ?mol-1
据此推理以下结论正确的是:
A.碳单质均易在空气中燃烧
B.等质量的石墨比金刚石能量高
C.1mol石墨转化为金刚石只需要吸收1.9KJ的热量
D.石墨和金刚石很容易相互转化
I.(6分)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃烧水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g); ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_________(填“>”“=”或“<”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
(3)已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
Ⅱ.(6分)(1) 在25℃、101 kPa下,1 g液态甲醇(CH3OH)燃烧生成CO2和液态水时放热22.7 kJ,则该反应的热化学方程式应为 。
(2).由氢气和氧气反应生成1 mol液态水时放热285.8 kJ,写出该反应的热化学方程式 ___________________ _________________。若1g水蒸气转化成液态水放热2.444 kJ,则反应2H2(g) + O2(g) === 2H2O(g)的△H= 。
CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
 CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡时n(CH3OH ) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |

能源的开发利用与人类社会的可持续发展息息相关。
Ⅰ.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=a kJ·mol-1
CO(g)+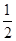 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________ kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:______________________________________
_______________________________________________________________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中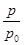 与时间t的关系如图所示。
与时间t的关系如图所示。
请回答下列问题: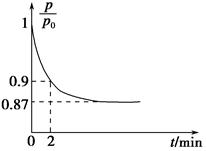
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
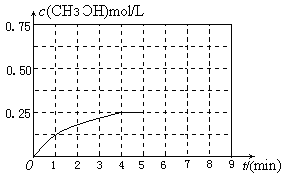
②0~2 min内,以c(N2)变化表示的平均反应速率为________。
③欲提高N2的转化率,可采取的措施有________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25 ℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32—)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________ mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com