
题目列表(包括答案和解析)
(11分)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
____________ 。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。
①A 点时剩余固体的成分是_________ (填化学式)。
②从开始加热到 750K 时总反应方程式为______________________ _。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为 mol·L-1。
(11分)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
____________ 。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。
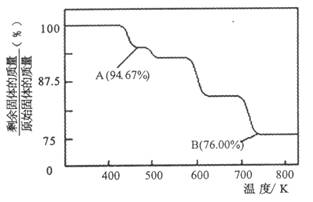
①A 点时剩余固体的成分是_________ (填化学式)。
②从开始加热到 750K 时总反应方程式为______________________ _。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为 mol·L-1。
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢。K2Cr2O7和CrO3大量用于鞣革、印染、颜料、电镀等工业中,是工业上造成铬污染的主要原因。近期暴光的“毒胶囊”事件中,就是因为用工业皮革的下脚料或破皮鞋等为原料制成的工业明胶被冒充成食用明胶制成胶囊,造成胶囊内的铬严重超标。
 (1)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。
(1)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。
①A 点时剩余固体的成分是 (填化学式)。
②从开始加热到 750K 时总反应方程式为 。
(2)Cr(Ⅵ)主要以CrO42-和Cr2O72-形态存在,在酸性条件下具有很强的氧化性,它们在溶液中存在如下转化:ks5u
CrO42-(黄色)+2H+ ![]() Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是 。
Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是 。
A.加NaOH B.加盐酸 C.加硫酸 D.加AgNO3
(3)工业废水中常含有一定量的Cr(Ⅵ),毒性较大,它们会对人类及生态系统产生很大损害。净化处理方法之一是将含Cr2O72-的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀以除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是 。ks5u
②写出阳极的电极反应式 。
③写出Fe2+和Cr2O72-发生反应生成Fe3+和Cr3+的离子反应方程式 。
④已知电解后的溶液中c(Fe3+)=2.0×10-13 mol·L-1,则溶液中c(Cr3+)为 mol·L-1。
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的化学方程式为:________.
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示.
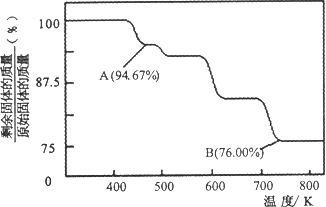
①A点时剩余固体的成分是________(填化学式).
②从开始加热到750 K时总反应方程式为________.
(3)CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31].
①电解过程中NaCl的作用是________.
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为________mol·L-1.
 I.在化学实验时必须注意安全操作,避免意外伤害,下列实验操作或事故处理不正确的是
I.在化学实验时必须注意安全操作,避免意外伤害,下列实验操作或事故处理不正确的是| 鉴别对象 | 实验操作、现象 |
| Cu2+ | 取少量待测溶液于试管中,滴入几滴NaOH溶液,有蓝色沉淀生成 取少量待测溶液于试管中,滴入几滴NaOH溶液,有蓝色沉淀生成 |
| SO42- | 取少量待测溶液于试管中,加入盐酸酸化,再滴入几滴BaCl2溶液,有白色沉淀生成. 取少量待测溶液于试管中,加入盐酸酸化,再滴入几滴BaCl2溶液,有白色沉淀生成. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com