
题目列表(包括答案和解析)
 CH3OH(g) △H=
CH3OH(g) △H=

甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0.
CH3OH(g) ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母).
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是________
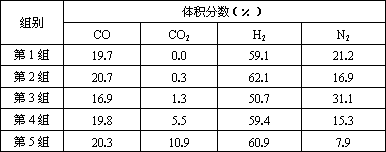
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
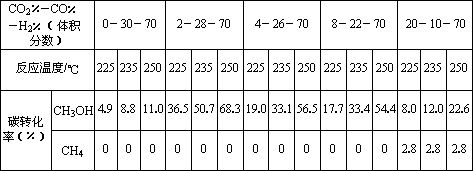
(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率________.
结论二:________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验.
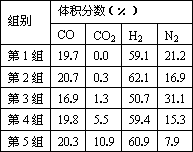
进行该验证实验时,控制不变的因素有________、________、________等.
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0.
CH3OH(g) ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母)
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是__________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:

(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率________.
结论二:CO2含量对反应的影响为__________________
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g)ΔH<0.
CH3OH(g)ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母).
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是________________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
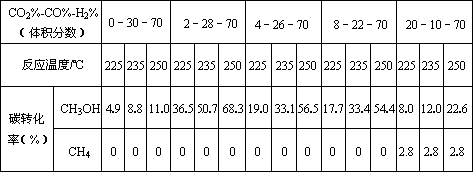
(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率__________.
结论二:_____________________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验.
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com