
题目列表(包括答案和解析)
(14分)实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达终点时溶液由______色变为_______色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1~2滴指示剂; ②向锥形瓶中加20mL~30mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.4000g ~ 0.6000g邻苯二甲酸氢钾加入250mL锥形瓶中; ⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?
______________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果____________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00mL,则NaOH溶液的物质的量浓度为___________。(结果保留四位有效数字)
(14分)实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达终点时溶液由______色变为_______色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小。)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1~2滴指示剂; ②向锥形瓶中加20mL~30mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.4000g ~ 0.6000g邻苯二甲酸氢钾加入250mL锥形瓶中; ⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是________________________________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?
______________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果____________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00mL,则NaOH溶液的物质的量浓度为___________。(结果保留四位有效数字)
( 14分)
(1)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:
苯(甲苯) ;苯(乙醇) ;甲苯(溴) 。
(2)实验室由电石中的碳化钙和水反应制取乙炔,该反应的化学方程式为 ,实验中为了减缓反应速率,常用 代替水,若实验中产生的气体存在难闻的气味,可以用_________________(填试剂)加以除去。
(3)某兴趣小组的同学在实验室里制取的乙烯中常混有少量二氧化硫,他们设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
1)I、II、III、IV装置可盛放的试剂依次为 (填字母)
①品红溶液 ②NaOH溶液 ③浓硫酸 ④酸性KMnO4溶液
A. ④②①③ B.①②①③ C. ①②①④ D. ④②①④
2)能说明SO2气体存在的现象是 。
3)使用装置III的目的是 。
4)确定含有乙烯的现象是 。
(每空2分,共14分)下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
① G是一种红棕色粉末、C既能与盐酸又能与NaOH溶液反应
② I是一种常见的温室气体,它和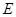 可以发生反应:2E+I
可以发生反应:2E+I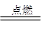 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.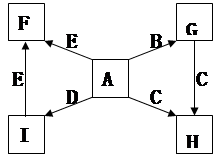
回答问题:
(1)写出G→H的化学方程式为________________________;
此反应在工业上常用于焊接钢轨,实验室在演示该实验时,在装置中加入G、C混合物后,引发此反应的操作是 ;
(2)化合物Ⅰ的电子式为______________________,
(3)用适量的盐酸溶解G后,所得溶液叫蚀铜剂,常用来洗涤印刷电路板上的铜,写出该反应的离子方程式为________________;
(4)E在I中燃烧观察到的现象是_______________________。
(5)在氩气的保护下,将一定计量的C、E加热熔炼可获得一种潜在的贮氢材料E17C12,该材料吸氢的反应方程式为E17C12+17H2 = 17EH2+12C
①熔炼制备贮氢材料E17C12时通入氩气的目的是
②1mol E17C12完全吸氢后,将得到的产物与足量的盐酸完全反应。释放出H2的物质的量为
(共14分)某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
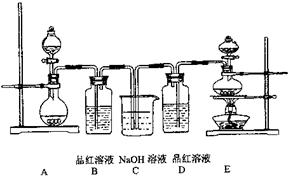
(1)实验室常用装置E制各Cl2,写出该反应的离子方程式__________________________指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:B D
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
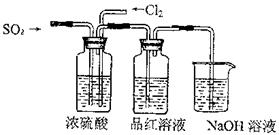
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是: 。(用离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com