
题目列表(包括答案和解析)
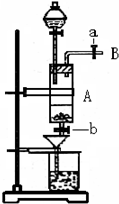
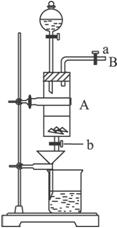
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是__________________________________________________________________。
(2)烧杯内放过量稀HNO3的原因是_______________________________________________,
发生反应的离子方程式是________________________________________________。
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是________
____________________________________________________________________。
(4)利用这个装置进行实验,你认为该实验存在的缺点可能有:
__________________________,__________________________。(写两条即可)
(5)乙同学对该实验进行了改进,他是用空烧杯承接滤液,加入适当的试剂,然后在HCl的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl3·6H2O,你认为加入的试剂可以是_____________。(填序号)①适量氯气 ②适量过氧化氢和稀盐酸 ③高锰酸钾酸性溶液 ④氢氧化钠溶液
在HCl的气流中、一定温度下蒸发、浓缩、降温结晶的理由是__________________________
_____________________________________________________________________。
(12分)已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。请完成以下实验探究过程:
【提出假设】
假设1:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学
式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案: 。
假设2方案: 。
(2)根据高中所学的知识判断,你认为 (填“假设1”或“假设2”)的推断是正确的;若选用淀粉—碘化钾溶液验证你的假设是否可行? (填“可行”或“不可行”),理由是 。
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为 。
(12分)已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。请完成以下实验探究过程:
【提出假设】
假设1:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学
式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案: 。
假设2方案: 。
(2)根据高中所学的知识判断,你认为 (填“假设1”或“假设2”)的推断是正确的;若选用淀粉—碘化钾溶液验证你的假设是否可行? (填“可行”或“不可行”),理由是 。
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com