
题目列表(包括答案和解析)
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两
个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有lO个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物
质混合后可得D和一种白色沉淀。![]() 离子与Ar原子的电子层结构相同。请回答:
离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极
性分子的有 (写化学式)。
(2)下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体 b.该分子的稳定性与氢键有关
c.分子由各原子最外层均为8![]() 。的稳定结构
。的稳定结构
d.含1 mol B的液体中有3 mol氢键
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型
 是 。
是 。
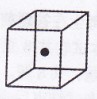
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结
构,右图立方体中心的“●”表示该晶体中的一个原子,请在该
立方体的顶点上用“●”表示出与之紧邻的原子。
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中
不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键
f.配位键 g.![]() 键 h.
键 h.![]() 键
键
(12分)
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
![]()
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: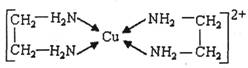
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为_________。
 (3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_______________________________________。
(3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_______________________________________。
(4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
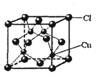
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
(12分,本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分)

(1)Fe2+在基态时,核外电子排布式为 。
(2)羟胺(NH2OH)中采用sp3杂化的原子有 ,羟胺熔沸点较高,是因为分子间存在较强的 。
(3)Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为 。
(4)根据价层互诉理论,C1O4—空间构形为 。
(5)铁能与氮形成一种磁性材料,其晶胞结构如图2,则该磁性材料的化学式为 。
B.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下:
①将三口烧瓶和锥形瓶做干燥处理,先向三口烧瓶中加入20g菜籽油,再称取40g正已烷(约61mL)。
②称取甲醇4.6g(约5.8mL)放到锥形瓶中,然后称取0.2g氢氧化钠固体并使之溶解,然后加到三口烧瓶中。
③如下图所示安装三口烧瓶。
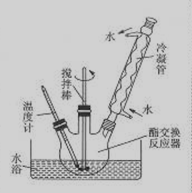
④恒温水浴加热,使温度保持在60—65℃左右,搅拌1.5—2h。
⑤停止加热后,冷却,取出三口烧瓶,静置、分液,上层
为生物紫油,正已烷和甲醇,下层主要为甘油。
⑥用温水洗涤制得的生物柴油3—4次。
⑦将水洗后的溶液倒入圆底烧瓶中,蒸馏,温度保持在
120℃左右,直至无液体蒸出后,烧瓶中剩余的液体主要即为
生物柴油。
(1)氢氧化钠的作用是 。
(2)正已烷的作用是 。
(3)图中冷凝管的作用是 。
(4)步骤⑤分液,用到的主要的一种玻璃仪器是 (写名称)
(5)确定步骤⑥已洗涤干净的方法是 。
(6)酸价(1g油酯的游离脂肪酸所需氢氧化钾的毫克数)的测定
a. 称取均匀试样Wg注入锥形瓶中,加入石油醚—乙醇混合液25mL,摇动锥形瓶使试样溶解。
b.滴入3滴酚酞,用0.100 mol/L KOH溶液滴定至出现微红色且保持30s不消失,消耗KOH溶液VmL。
则该生物柴油的酸价为 (用含W、V的代数式表示)
(12分)【选做题】本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。
若多做,则按A小题评分。
A.[物质结构与性质]
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
 (1)X与Y所形成化合物晶体的晶胞如右图所示。
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ2-
①YZ2-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
(本题包括一小题,共12分)
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为 ;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为 、 ;
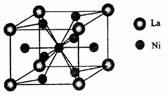
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 ;
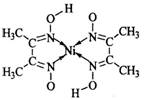
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是 ,氮镍之间形成的化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子的杂化轨道类型有 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com