
题目列表(包括答案和解析)
A.欲测某溶液的pH,是用洁净、干燥的玻璃棒蘸取该溶液,点在干燥的pH试纸上,观察试纸的颜色,并与标准比色卡比较
B.将浓H2SO4和乙醇按体积比3:1混合,置于圆底烧瓶,加热,使温度迅速升高到
C.将饱和FeCl3溶液滴入蒸馏水中即得Fe(OH)3胶体
D.取1mol/L CuSO4溶液和0.5mol/LNaOH溶液各lmL,在一支洁净的试管内混合后,向其中又加入0.5mL40%乙醛加热至沸,将产生红色沉淀
E.定性检验C2H5Br中的溴元素,将C2H5Br和NaOH溶液混合加热后,加硫酸酸化
F.向苯酚溶液中滴加少量浓溴水,振荡,无现象
(2)请用图2-4所示的仪器装置,设计一个电解饱和MgCl2溶液,来测定电解时产生的氢气的体积,并检验氯气的氧化性。
图2-4
①所选仪器连接时各接口的顺序是(填各接口的代号字母):
A接_______、________接_______;B接________、________接________。
②实验时,装置中的石墨电极接电源的____________极,所发生的反应为__________________,铁电极接电源的____________极,所发生的反应为____________,此电解总反应方程式为________________________。
下列有关实验的叙述,正确的是________(填字母序号)(有错误选项得0分)
A.配制0.1 mol/L的氯化钠溶液时,将称量的氯化钠固体直接加入容量瓶,再加水至刻度线
B.用洁净且干燥的玻璃棒蘸取待测液滴到放在表面皿上的pH试纸上,与标准比色卡对照,测溶液的pH
C.滴定管洗净后,经蒸馏水润洗后注入标准液进行滴定
D.向20 mL煮沸的蒸馏水中滴加FeCl3饱和溶液1~2 mL,继续煮沸1~2分钟,待溶液呈红褐色即得Fe(OH)3胶体
E.用浓氨水洗涤做过银镜反应的试管
F.除去苯中的少量的苯酚,加足量的氢氧化钠溶液,然后分液
G.用水鉴别苯、甘油和硝基苯三种无色液体
H.配制氯化亚铁溶液时,需加少量盐酸及铁粉;
I.用10 mL量筒量取5.80 mL盐酸
J.可用过滤法除去氧氢化铁胶体中少量的氯化铁和盐酸.
下列操作或说法合理的是________
A、用10毫升的量筒量取4.80毫升的浓硫酸
B、金属钠着火,用泡沫灭火器扑灭
C、用胶头滴管向试管滴液体时,滴管尖端与试管内壁一般不应接触
D、用盐酸可以清洗长期存放过石灰水的试剂瓶
E、配制FeCl3溶液时,向溶液中加入少量Fe和稀硫酸
F、用已知浓度的酸滴定未知浓度的碱时,碱式滴定管用蒸馏水洗后,未用待测液润洗会导致测量的浓度偏低
现有一份含有FeCl3和FeCl2固体的混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.22g
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4g
根据实验回答下列问题:
(l)溶解过程中所用到的玻璃仪器有_____________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂_________和_________。
(3)实验2中通入足量Cl2的目的是____________________________________。
涉及的化学反应的离子方程式是____________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法
_______________________________________________________________
_______________________________________________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)______________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是_____________(填写序号字母)。
A. 胶体粒子能透过滤纸,但不能透过半透膜
B. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C. 只有胶体粒子能作布朗运动
D. 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E. 在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为_________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)
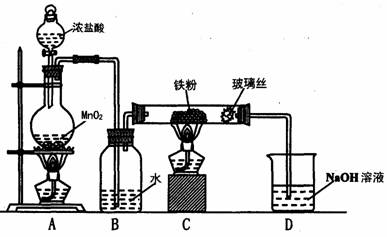
该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_______________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com