
题目列表(包括答案和解析)
实验:
(1)(4分)右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
①该浓盐酸中HCl的物质的量浓度为_________mol·L-1 。
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________ 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D溶液的密度
(2).(8分)实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体_______g
② 若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线_________
B.忘记将洗涤液加入容量瓶__________
C.容量瓶内壁附有水珠而未干燥处理____________
D.溶解后没有冷却便进行定容______________
(3)(8分)①取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为______________,反应后得到黄色的FeCl3溶液。用此溶液做以下实验:
②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成,反应的离子方程式为____________________________________。
③在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3饱和溶液,继续煮沸至溶液呈________色,即可制得Fe(OH)3胶体。
④另取一小烧杯加入25 mL蒸馏水后,向烧杯中再加入2 mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到________(填甲或乙)烧杯中会产生丁达尔效应。此实验可以区别
实验:
(1)(4分)右图为实验室某浓盐酸 试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: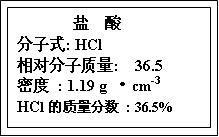
①该浓盐酸中HCl的物质的量浓度为_________mol·L-1。
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________ 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D溶液的密度
(2).(8分)实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体_______g
② 若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线_________
B.忘记将洗涤液加入容量瓶_________ _
_
C.容量瓶内壁附有水珠而未干燥处理____________
D.溶解后没有冷却便进行定容____________ __
__
(3)(8分)①取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为______________,反应后得到黄色的FeCl3溶液。用此溶液做以下实验:
②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成, 反应的离子方程式为____________________________________。
反应的离子方程式为____________________________________。
③在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3饱和溶液,继续煮沸至溶液呈________色,即可制得Fe(OH)3胶体。
④另取一小烧杯加入25 mL蒸馏水后,向烧杯中再加入2 mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到________(填甲或乙)烧杯中会产生丁达尔效应。此实验可以区别

(14分)实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取w g无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选_______________,当滴定溶液由_____色变成_____色时,即表示达滴定终点.
(2)若滴到终点时,中和w g Na2CO3消耗盐酸V mL,则盐酸的物质的量浓度为________mol·L—1。
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol·L-1,用不纯的Na2CO3标定测得盐酸为c2mol·L-1,在下述情况下,c1,c2的关系是 (空填>、<或=)
①当Na2CO3中含有NaHCO3时,cl_____c2;
②当Na2CO3中含有NaOH时,cl_____c2;
③当Na2CO3中含有Na2CO3·10H2O时,cl_____c2。
实验室合成环己酮的反应、装置示意图及有关数据如下:
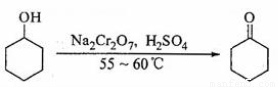 ?????????
????????? 
环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
环己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
环己酮 | 155.6(95) | 0.9478 | 微溶于水 |
饱和食盐水 | 108.0 | 1.3301 |
|
水 | 100.0 | 0.9982 |
|
括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
①如何滴加酸性Na2Cr2O7溶液 ????????????????????? ,用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是 ??????????? 。
②蒸馏不能分离环己酮和水的原因是 ????????????????????????????????? 。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~ 156℃馏分,b.过滤,c.在收集到的馏分中加NaCl固体至饱和,静置,分液,d.加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 ?????????? (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有 ?? 。
③在上述操作c中,加入NaCl固体的作用是 ???????????????????????????? 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
(14分)实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取w g无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选_______________,当滴定溶液由_____色变成_____色时,即表示达滴定终点.
(2)若滴到终点时,中和w g Na2CO3消耗盐酸V mL,则盐酸的物质的量浓度为________mol·L—1。
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol·L-1,用不纯的Na2CO3标定测得盐酸为c2mol·L-1,在下述情况下,c1,c2的关系是 (空填>、<或=)
①当Na2CO3中含有NaHCO3时,cl_____c2;
②当Na2CO3中含有NaOH时,cl_____c2;
③当Na2CO3中含有Na2CO3·10H2O时,cl_____c2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com