
题目列表(包括答案和解析)
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
| 2a |
| V |
| 2a |
| V |
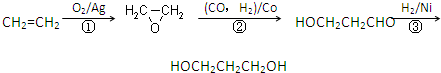
| ||
| ||
(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(2)500℃、50MPa时,在容积为V L的容器中加入1 molN2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为 。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2OCO+H2 CH4+H2O
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭 吨、甲烷 吨,
才能满足生产需要。
(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=C O+3H2。部分物质的燃烧热数据如下表:
O+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
 4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式
4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式  。
。
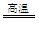 CO+H2 CH4+H2O
CO+H2 CH4+H2O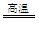 CO+3H2
CO+3H2(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为 。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
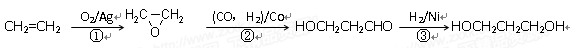
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭 吨、甲烷 吨,
才能满足生产需要。



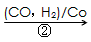 HOCH2CH2CHO
HOCH2CH2CHO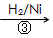 HOCH2CH2CH2OH
HOCH2CH2CH2OH 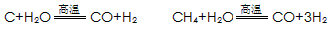
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com