
题目列表(包括答案和解析)
Ⅰ右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D分别表示________、________族元素气态氢

化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是________;
图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是________
Ⅱ.已知氨分子内键与键的夹角约为107o18’.从反应NH3+H+→NH4+可知:NH4+中有一根键比较特殊,其结构可表示为A式.但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109o28’.故NH4+的结构也可表示为B式.

(1)还有一些你熟悉的分子或离子中,也存在上述特殊共价键,如:________等.
(在下列微粒中选择填空:[Ag(NH3)2]+,PCl5,Fe(SCN)3,NH3·H2O,H3O+)
(2)写出H3O+的电子式________;你认为H3O+中键与键的夹角与下列哪个角度最接近?________
A、120o
B、109o28'
C、107o18'
D、60o
(3)氮化硼(BN)是一种新型无机非金属材料,它有两种晶型:金刚石晶型和石墨晶型.其中,金刚石晶型的氮化硼材料具有硬度大、熔点高等特性,它的结构中也含有上述特殊共价键.则:在金刚石晶型的氮化硼中,每个硼原子与________个氮原子以B─N键连接,原子间相互连接的最小的环上有________个氮原子和________个硼原子.
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
|
|
甲 |
乙 |
丙 |
|
反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
|
达到平衡的时间/min |
|
5 |
8 |
|
平衡时N2的浓度/mol·L-1 |
c1 |
1.5 |
|
|
NH3的体积分数 |
ω1 |
|
ω3 |
|
混合气体密度/g·L-1 |
ρ1 |
ρ2 |
|
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
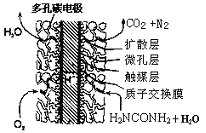
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4 (l) (氨基甲酸铵)
△H1
H2NCOONH4 (l) (氨基甲酸铵)
△H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)
△H2
H2O(l)+H2NCONH2(l)
△H2
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
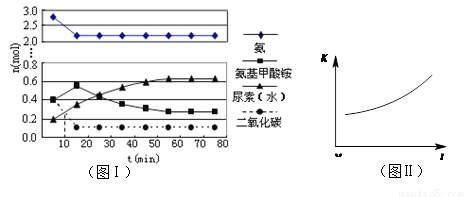
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为 (写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H =a kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2=bkJ· kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = c kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H= 。
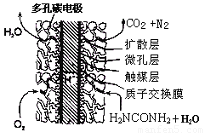
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 甲 | 乙 | 丙 | ||
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 | ||
| 达到平衡的时间/min | | 5 | 8 | ||
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | | ||
| NH3的体积分数 | ω1 | | ω3 | ||
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
 H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2 
 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 甲 | 乙 | 丙 | ||
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 | ||
| 达到平衡的时间/min | | 5 | 8 | ||
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | | ||
| NH3的体积分数 | ω1 | | ω3 | ||
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
 H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2 

在烧杯中加入一定量的枯草浸出液,烧杯中的枯草杆菌以其中的有机物为食。过几天后放入大草履虫,再过一段时间后,放入双小核草履虫,它们均以枯草杆菌为食。三种生物在浸出液中数量的增减情况如右图所示,据图分析错误的是 ( )
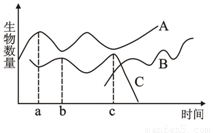
A.枯草杆菌和草履虫之间构成捕食关系,两种草履虫之间构成竞争关系
B.A、B两条曲线分别表示枯草杆菌和双小核草履虫的数量变化情况
C.烧杯内混合培养的每一种生物,均存在种内斗争
D.经过足够长的时间后,A、B两条曲线最终趋向动态平衡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com