
题目列表(包括答案和解析)
[查阅资料]
①铁的常见氧化物
氧化亚铁(FeO)黑色固体,w(Fe)=77.8%;氧化铁(Fe2O3)红色固体,俗称铁红,w(Fe)=70.0%;四氧化三铁(Fe3O4)黑色固体,俗称磁性氧化铁,w(Fe)=72.4%。
②草酸(乙二酸H2CO4)在浓H2SO4存在下受热分解的化学方程式为:
H![]() CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
[实验准备]
①实验的装置图如下

②药品及试剂
a.草酸 b.工业铁红 c.NaOH溶液 d.澄清石灰水 e.浓H2SO
[实验及数据]取不同质量的样品进行实验,所得实验数据如下:
实验序号 | 样品质量/g | 生成铁的质量/g |
1 | 4.00 | 2.91 |
2 | 8.00 | 7.00 |
3 | 10.00 | 7.27 |
4 | 12.00 | 8.72 |
5 | 14.00 | 10.18 |
6 | 16.00 | 11.63 |
[讨论与分析]
(1)兴趣小组的同学拟以纯净的CO还原铁的氧化物,所设计的实验装置中D、E、F应分别盛放的试剂为______________、______________、______________(填写序号,下同),其作用依次是____________________________。上述装置还有不完善之处,你建议改进措施是__________________________________________。
(2)由实验数据不难得出,有一组实验数据不可靠,该组数据是______________(填序号),该工业粗铁红所含杂质的化学式为______________。
(3)该工业铁红中w(Fe2O3)=______________。
【查阅资料】
①铁的常见氧化物
名称 | 化学式 | 色、态 | 铁元素的质量分数 |
氧化亚铁 | FeO | 黑色粉末 | w(Fe)=77.8% |
氧化铁 | Fe2O3 | 红棕色粉末(俗称铁红) | w(Fe)=70.0% |
四氧化三铁 | Fe3O4 | 黑色晶体(俗称磁性氧化铁) | w(Fe)=72.4% |
②草酸(乙二酸H2C2O4)在浓硫酸存在下受热分解的化学方程式为H2C2O4![]() CO2↑+ CO↑+H2O
CO2↑+ CO↑+H2O
【实验准备】
①实验的装置图如下

②药品
a.草酸 b.工业铁红 c.NaOH溶液 d.澄清石灰水 e.浓硫酸 f.盐酸
【实验及数据】
取不同质量的样品进行实验,所得实验数据如下:
实验序号 | 样品质量/g | 生成铁的质量/g |
1 | 4.00 | 2.91 |
2 | 8.00 | 7.00 |
3 | 10.00 | 7.27 |
4 | 12.00 | 8.72 |
5 | 14.00 | 10.18 |
6 | 16.00 | 11.63 |
【讨论与分析】
(1)兴趣小组的同学拟以纯净的CO还原铁的氧化物,所设计的实验装置中D、E、F应分别盛放的试剂为____________、____________、___________(填写序号),其作用依次是____________、____________、_____________。上述装置还有不完善之处,你建议改进的措施是________________________。
(2)由实验数据不难得出,有一组实验数据不可靠,该组数据是____________(填序号),该工业铁红所含杂质的化学式为________________________。

| ||
| ||
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示:
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。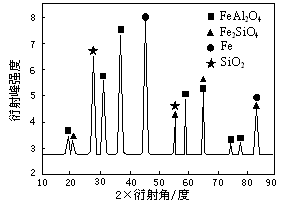
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。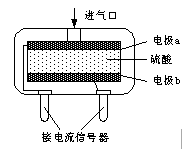
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示: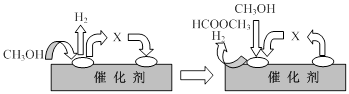
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。
⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。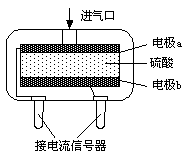
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com