
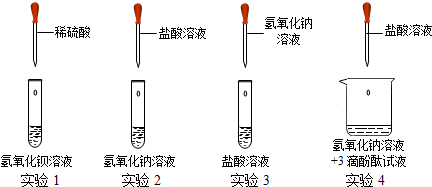
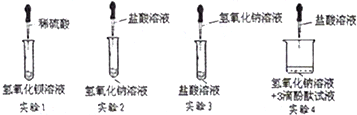
题目列表(包括答案和解析)
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升(△t)/℃ | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升(△t)/℃ | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
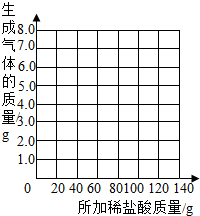
| 加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
| 生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | -- |
小青在实验室发现一瓶长期敞口放置的浓盐酸,为方便以后使用,他对其浓度进行了测定。取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)测定溶液的pH,得到的数据如下:
| 加入氢氧化钠的体积/mL | 0 | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 |
| 烧杯中溶液的pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |
(1)请你绘制出烧杯中溶液的pH与加人氢氧化钠溶液体积(V)之间的变化关系图。

(2)请根据上图找出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积数,并据此计算此瓶盐酸的溶质质量分数。(氢氧化钠溶液的密度按1.0g/mL计算)
小青在实验室发现一瓶长期敞口放置的浓盐酸,为方便以后使用,他对其浓度进行了测定。取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)测定溶液的pH,得到的数据如下:
| 加入氢氧化钠的体积/mL | 0 | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 |
| 烧杯中溶液的pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |
(1)请你绘制出烧杯中溶液的pH与加人氢氧化钠溶液体积(V)之间的变化关系图。

(2)请根据上图找出氢氧化钠与盐酸恰好完全反应时,所滴加氢氧化钠溶液的体积数,并据此计算此瓶盐酸的溶质质量分数。(氢氧化钠溶液的密度按1.0g/mL计算)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com