
题目列表(包括答案和解析)
(12分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作 。
如何确定E中空气已被赶尽:__________________________________ 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。
(3)如何证明E中收集到的是NO而不是H2?
______________________________________________________
一段时间后,C中白色沉淀溶解,其原因是
________________________________________________________
(12分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。

(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作 。
如何确定E中空气已被赶尽:__________________________________ 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。
(3)如何证明E中收集到的是NO而不是H2?
______________________________________________________
一段时间后,C中白色沉淀溶解,其原因是
________________________________________________________
(12分) 为了进行氨的催化氧化实验:4NH3+5O2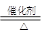 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
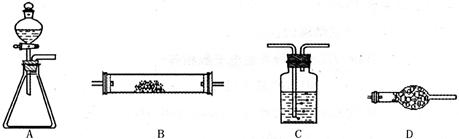
将所选的仪器按连接顺序由上至下依次填入下表(可不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器(填字母) |
加入的试剂 |
作用 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(12分) 为了进行氨的催化氧化实验:4NH3+5O2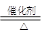 4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。
4NO+6H2O。请从下图中选用所需的仪器(可重复使用)组成一套进行该反应的简单装置。现提供试剂:过氧化钠、碱石灰、铂粉、氯化钙、浓硫酸、浓氨水和氢氧化钠溶液。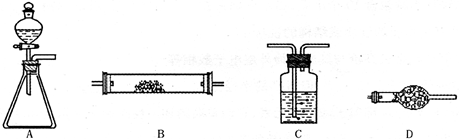
将所选的仪器按连接顺序由上至下依次填入下表(可不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器(填字母) | 加入的试剂 | 作用 |
| | | |
| | | |
| | | |
| | | |
(共12分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴ 实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出
113.5kJ的热量,试写出甲醇燃烧的热化学方程式: ▲ 。
⑵ 已知:Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)ΔH=-226kJ/mol 则反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g ) ΔH ▲ -452kJ/mol(填“>”、“<”、“=”)
⑶由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值:___▲___。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值:___▲___。
⑷ 依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:__▲_。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com