
题目列表(包括答案和解析)
(1)若两极均为铜片,试说明电解过程中Cu2+浓度将怎样变化。
。
(2)若阳极为纯锌,阴极为铜片,阳极的电极反应式是 。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重 g,阴极上的电极反应式是 。
在150 mL 0.2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水的电解),则:
(1)若两极均为铜片,试说明电解过程中Cu2+浓度将怎样变化。_____________________。
(2)若阳极为纯锌,阴极为铜片,阳极的电极反应式是______________________________。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是___________________________。
在150 mL 0.2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水的电解),则:
(1)若两极均为铜片,试说明电解过程中Cu2+浓度将怎样变化。
。
(2)若阳极为纯锌,阴极为铜片,阳极的电极反应式是 。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重 g,阴极上的电极反应式是 。
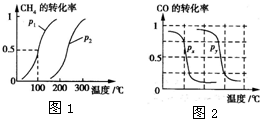 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:| 实验编号 | T(℃) | n(CO)/n(H2) | ρ(MPa) | ||
| 1 | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
| 1 |
| 3 |
| 1 |
| 3 |
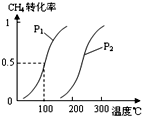 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和反应②,用CH4和H2O为原料来制备甲醇(CH3OH).
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和反应②,用CH4和H2O为原料来制备甲醇(CH3OH).| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | ||
| I | 150 |
|
0.1 | ||
| II | 5 | ||||
| III | 350 | 5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com