
题目列表(包括答案和解析)
2- 8 |
- 3 |
2- 4 |
- 3 |
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol?L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A. 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 |
a.溶液pH=8 | i. S2O32-+H2O?HS2O3-+OH- S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b. 有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 |
ii.S2O32一+2H+═ S↓+SO2↑+H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii. S2O32-+4C12+5H2O=2SO42-+8C1-+10H+ S2O32-+4C12+5H2O=2SO42-+8C1-+10H+ |
.(8分)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。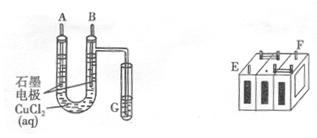
(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)某学生试图用上述装置,根据电极上析出的物质的质量来测定阿伏加德常数的值。通电时间t s,测定通过电路的电流强度为I。精确测得A电极析出铜的质量的操作包括以下几步:
①低温烘干电极后称量
②用蒸馏水清洗电解后的电极
③称量电解前的电极质量
④再次低温烘干后称量
正确的操作顺序是 ;
(3)若经过上述操作测定生成铜的质量为mg,试列出计算阿伏加德罗常数的表达式(已知一个电子电量为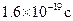 ):
):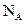 =
= 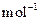
.(8分)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。
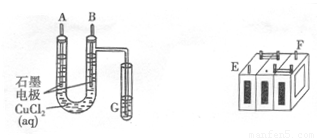
(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)某学生试图用上述装置,根据电极上析出的物质的质量来测定阿伏加德常数的值。通电时间t s,测定通过电路的电流强度为I。精确测得A电极析出铜的质量的操作包括以下几步:
①低温烘干电极后称量
②用蒸馏水清洗电解后的电极
③称量电解前的电极质量
④再次低温烘干后称量
正确的操作顺序是 ;
(3)若经过上述操作测定生成铜的质量为mg,试列出计算阿伏加德罗常数的表达式(已知一个电子电量为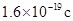 ):
):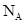 =
=
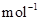
.(8分)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。
(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)某学生试图用上述装置,根据电极上析出的物质的质量来测定阿伏加德常数的值。通电时间t s,测定通过电路的电流强度为I。精确测得A电极析出铜的质量的操作包括以下几步:
①低温烘干电极后称量
②用蒸馏水清洗电解后的电极
③称量电解前的电极质量
④再次低温烘干后称量
正确的操作顺序是 ;
(3)若经过上述操作测定生成铜的质量为mg,试列出计算阿伏加德罗常数的表达式(已知一个电子电量为![]() ):
):![]() =
= ![]()
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com