
题目列表(包括答案和解析)
|
一定条件下,电解较稀浓度的硫酸,其还原物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2 | |
| [ ] | |
A. |
电解池的阳极生成双氧水,阴极生成臭氧 |
B. |
电解池中硫酸溶液的pH保持不变 |
C. |
产生臭氧的电极反应式为3H2O-6e- |
D. |
产生双氧水的电极反应式为2H2O-2e- |
一定条件下,电解较稀浓度的硫酸,其还原产物为双氧水,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2=O3+3H2O2。下列有关说法正确的是( )
A.电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-=O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-=H2O2+2H+
一定条件下,电解较稀浓度的硫酸,H2O2仅为还原产物,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2![]() O3+3H2O2。下列有关说法正确的是 ( )
O3+3H2O2。下列有关说法正确的是 ( )
A.电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-=O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-= H2O2+2H+
一定条件下,电解较稀浓度的硫酸,H2O2仅为还原产物,该原理可用于制取双氧水,其电解的化学方程式为:3H2O+3O2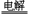 O3+3H2O2。下列有关说法正确的是 ( )
O3+3H2O2。下列有关说法正确的是 ( )
A.电解池的阳极生成双氧水,阴极生成臭氧
B.电解池中硫酸溶液的pH保持不变
C.产生臭氧的电极反应式为3H2O-6e-=O3+6H+
D.产生双氧水的电极反应式为2H2O-2e-= H2O2+2H+
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下:
(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
【问题2】已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
① 请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
② 根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com