
题目列表(包括答案和解析)
乙醇是一种可燃性液体,按一定比例混合的乙醇汽油是一种新型清洁车用燃料,某科研机构研究利用CO2合成乙醇的方法:
(i)2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH1
CH3CH2OH(g)+3H2O(g) ΔH1
原料气氢气
(ii)CH4(g)+H2O(g)  CO(g)+3H2(g)?? ΔH2
CO(g)+3H2(g)?? ΔH2
回答下列问题:
(1)使用乙醇汽油(汽油用戊烷代替)燃料时.气缸工作时进行的反应较多,写出燃烧产生有毒气体CO、NO的所有反应的化学方程式:________________________。
(2)反应(i)中能够提高氢气转化率的措施有____。
A.增大压强????? B.加催化剂?????? C.增大CO2的浓度????? D.及时分离体系中的乙醇
(3)利用CO合成乙醇是目前工业生产较为成熟的工艺。已知下列热化学方程式:
(iii)CO(g)+H2O(g)  CO2(g)+H2(g)?? ΔH3
CO2(g)+H2(g)?? ΔH3
写出以CO(g)与H2(g)为原料合成乙醇的热化学方程式:___________________(焓变用 H1、
H1、 H3表示)。
H3表示)。
(4)反应(ii)中的甲烷和水蒸气是在特定的催化剂表面上进行的,该反应在不同温度下的化学平衡常数如下表:

?? 由此推知反应(ii)的焓变 H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
(5)机动车在改用乙醇汽油后,并不能减少氮氧化物的排放。使用合适的催化剂可使NO转化为氮气,实验测得NO转化为氮气的转化率随温度变化曲线如下图所示:
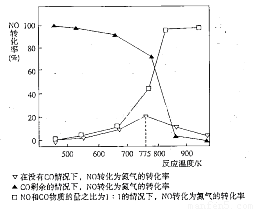
由图像可知,在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是___________________________;在NO和CO物质的量之比为1:1的情况下,应控制的最佳温度为__________________左右。
乙醇是一种可燃性液体,按一定比例混合的乙醇汽油是一种新型清洁车用燃料,某科研机构研究利用CO2合成乙醇的方法:
(i)2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH1
CH3CH2OH(g)+3H2O(g) ΔH1
原料气氢气
(ii)CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH2
CO(g)+3H2(g) ΔH2
回答下列问题:
(1)使用乙醇汽油(汽油用戊烷代替)燃料时.气缸工作时进行的反应较多,写出燃烧产生有毒气体CO、NO的所有反应的化学方程式:________________________。
(2)反应(i)中能够提高氢气转化率的措施有____。
| A.增大压强 | B.加催化剂 | C.增大CO2的浓度 | D.及时分离体系中的乙醇 |
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3 H1、
H1、 H3表示)。
H3表示)。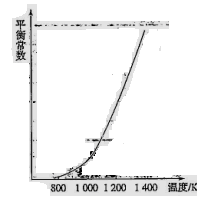
 H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。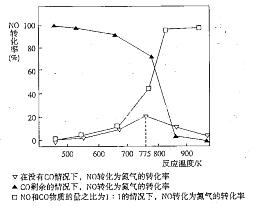
 CH3CH2OH(g)+3H2O(g) ΔH1
CH3CH2OH(g)+3H2O(g) ΔH1 CO(g)+3H2(g) ΔH2
CO(g)+3H2(g) ΔH2| A.增大压强 | B.加催化剂 | C.增大CO2的浓度 | D.及时分离体系中的乙醇 |
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3 H1、
H1、 H3表示)。
H3表示)。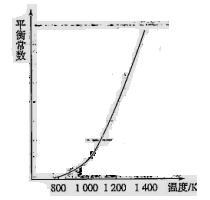
 H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。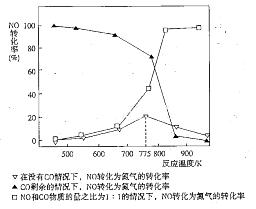
(21分)(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/LH2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃ (t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键 个 ,π 键 个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g)CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
①从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com