
题目列表(包括答案和解析)
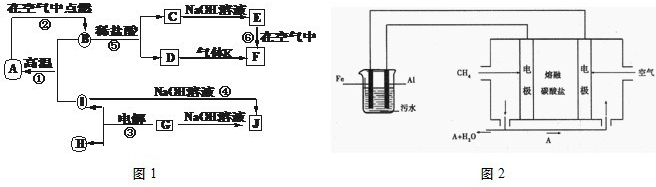
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+| CO | 2- 3 |
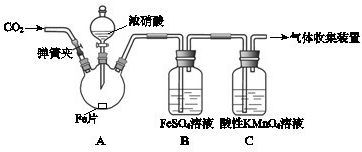
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
(共14分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
[探究二]
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。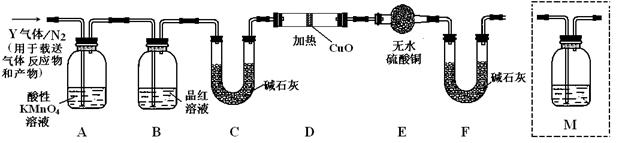
(3)装置B中试剂的作用是
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 (选填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
⑴ S、N、O的第一电离能由大到小的顺序为 。
⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
 ① 写出亚铁离子的基态电子排布式 。
① 写出亚铁离子的基态电子排布式 。
② CO有多种等电子体,其中常见的两种为 。
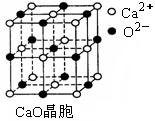
⑶ SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在
燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+的配位
数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分
别为:CaO-3 401kJ/mol、NaCl-786kJ/mol。CaO晶体的熔点 NaCl
晶体的熔点(填“高于”、“等于”或“低于”)。
⑷ 随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来
越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要
有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com