
题目列表(包括答案和解析)
水杨酸是合成阿斯匹林的重要原料。水杨酸的结构简式为
![]() 请回答下列问题:
请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团的名称 ;
![]() (2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式: ;
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式: ;
(3)写出水杨酸与碳酸氢钠反应的化学方程式:
(4)在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林如右图所示,1摩尔阿司匹林与氢氧化钠完全反应需要氢氧化钠 摩尔。
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
![]()
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: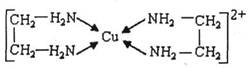
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为_________。
 (3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_______________________________________。
(3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_______________________________________。
(4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
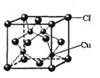
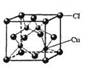
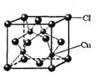
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
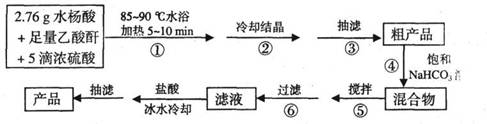
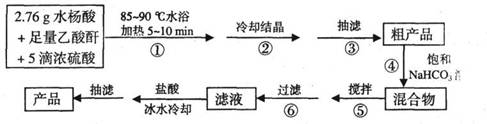
B.阿司匹林(乙酰水杨酸)是常用的解热镇痛药,以下是合成阿司匹林的工艺流程。
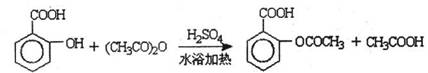
已知:①反应方程式为
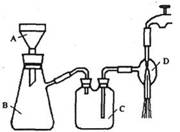
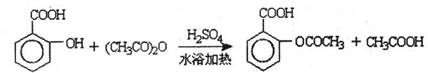
②抽滤的实验装置如右图所示。
请回答有关问题:
(1)仪器A的名称是_____________。
(2)在步骤②中,若冷却结晶时未出现结晶,可以___________,促使晶体析出。
(3)实验时,当仪器B中液面高度快达到支管口位置时,应进行的操作是____________________________________________。
(4)仪器C中两玻璃导管的位置是否正确?答:_________。(填“正确”或“不正确”)
(5)在步骤④中,用饱和NaHC03溶液可以将阿司匹林和剐产物等分离,其化学原理是
_________________________________________。要检测产品中是否含有水杨酸,其实验操作是_____________________________________________________。
(6)在步骤⑤中,搅拌使反应充分进行至_____________为止。
(7)若实验得到2.70g纯净的阿司匹林,则产品的产率为____________。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:
![]()
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
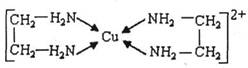
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为_________。
(3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_____________________________________________。
 (4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
(4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
B.阿司匹林(乙酰水杨酸)是常用的解热镇痛药,以下是合成阿司匹林的工艺流程。
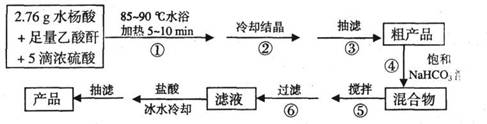
已知:①反应方程式为
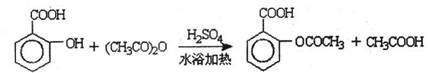
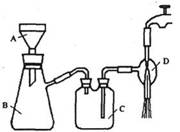
②抽滤的实验装置如右图所示。
请回答有关问题:
(1)仪器A的名称是_____________。
(2)在步骤②中,若冷却结晶时未出现结晶,可以___________,
促使晶体析出。
(3)实验时,当仪器B中液面高度快达到支管口位置时,应进行
的操作是____________________________________________。
(4)仪器C中两玻璃导管的位置是否正确?答:_________。(填“正确”或“不正确”)
(5)在步骤④中,用饱和NaHC03溶液可以将阿司匹林和剐产物等分离,其化学原理是
_________________________________________。要检测产品中是否含有水杨酸,其实验操作是_____________________________________________________。
(6)在步骤⑤中,搅拌使反应充分进行至_____________为止。
(7)若实验得到2.70g纯净的阿司匹林,则产品的产率为____________。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
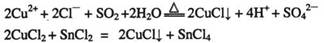
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: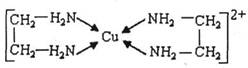
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为_________。
 (3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_______________________________________。
(3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_______________________________________。
(4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
B.阿司匹林(乙酰水杨酸)是常用的解热镇痛药,以下是合成阿司匹林的工艺流程。
已知:①反应方程式为
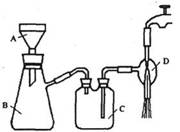
②抽滤的实验装置如右图所示。
请回答有关问题:
(1)仪器A的名称是_____________。
(2)在步骤②中,若冷却结晶时未出现结晶,可以___________,促使晶体析出。
(3)实验时,当仪器B中液面高度快达到支管口位置时,应进行的操作是____________________________________________。
(4)仪器C中两玻璃导管的位置是否正确?答:_________。(填“正确”或“不正确”)
(5)在步骤④中,用饱和NaHC03溶液可以将阿司匹林和剐产物等分离,其化学原理是
_________________________________________。要检测产品中是否含有水杨酸,其实验操作是_____________________________________________________。
(6)在步骤⑤中,搅拌使反应充分进行至_____________为止。
(7)若实验得到2.70g纯净的阿司匹林,则产品的产率为____________。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得:
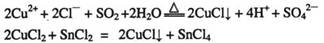
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
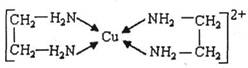
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为_________。
(3)乙二胺分子中氮原子轨道的杂化类型为_____________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_____________________________________________。
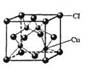 (4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
(4)②中所形成的配离子中含有的化学键类型有__________。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。
B.阿司匹林(乙酰水杨酸)是常用的解热镇痛药,以下是合成阿司匹林的工艺流程。
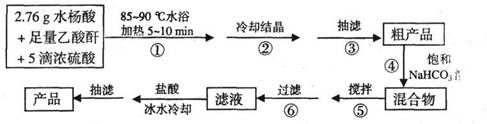
已知:①反应方程式为
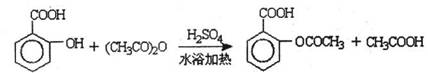
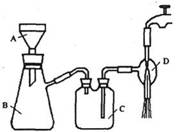
②抽滤的实验装置如右图所示。
请回答有关问题:
(1)仪器A的名称是_____________。
(2)在步骤②中,若冷却结晶时未出现结晶,可以___________,
促使晶体析出。
(3)实验时,当仪器B中液面高度快达到支管口位置时,应进行
的操作是____________________________________________。
(4)仪器C中两玻璃导管的位置是否正确?答:_________。(填“正确”或“不正确”)
(5)在步骤④中,用饱和NaHC03溶液可以将阿司匹林和剐产物等分离,其化学原理是
_________________________________________。要检测产品中是否含有水杨酸,其实验操作是_____________________________________________________。
(6)在步骤⑤中,搅拌使反应充分进行至_____________为止。
(7)若实验得到2.70g纯净的阿司匹林,则产品的产率为____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com