
题目列表(包括答案和解析)
(14分)(1)448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为
(2)12.4gNa2R中含Na+0.4mol,则Na2R的摩尔质量为 ,R的相对原子质量为
(3)5molCO2的质量是_________;在标准状况下所占的体积约为__________;所含的分子数目约为____________________;所含氧原子的数目约为___________________。
(14分)(1)448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为
(2)12.4gNa2R中含Na+0.4mol,则Na2R的摩尔质量为 ,R的相对原子质量为
(3)5molCO2的质量是_________;在标准状况下所占的体积约为__________;所含的分子数目约为____________________;所含氧原子的数目约为___________________。
(14分)
(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的电解质会泄漏出来,使电器腐蚀。后来人们采用了什么方法将其改造成了防漏电池。请列举一种方法即可_____________。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH4Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO2 + 2H2O ==== 2MnOOH + Zn(OH)2
写出该电池正极反应式___________。电池工作时,电子流向 (填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
(4)生产MnO2另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下:
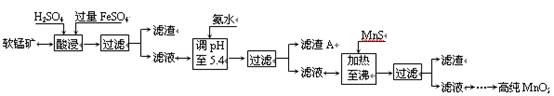
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥–0.42 |
≥2.5 |
≥7 |
≥7 |
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式
为 。
②加入MnS的目的是除去 杂质。
(14分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s) ![]()
2Al(s)+3/2O2(g)= Al2O3(s) 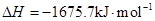
Al和FeO发生铝热反应的热化学方程式是________________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A、升高温度 B、增大反应物的浓度
C、降低温度 D、使用了催化剂
(3) 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+ 4H2(g) Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性_______ _____
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(14分)(1)448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为
(2)12.4gNa2R中含Na+0.4mol,则Na2R的摩尔质量为 ,R的相对原子质量为
(3)5molCO2的质量是_________;在标准状况下所占的体积约为__________;所含的分子数目约为____________________;所含氧原子的数目约为___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com