
题目列表(包括答案和解析)
Ⅰ.探究:实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%” 字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究。

提出问题:这瓶试剂可能是什么溶液呢?
交流讨论:根据受损标签的情况判断,这瓶试剂不可能是 A.酸 B.碱 C.盐
查阅资料:
①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
②Na2CO3和NaHCO3溶液都呈碱性。
③测定室温(20℃)时,四种物质的溶解度的数据如下:
|
物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
|
溶解度g |
36 |
109 |
215 |
9.6 |
得出结论:小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 。
设计实验并继续探究:
①小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是 。
②小强为了确定该溶液是哪种溶液,他又进行了如下实验:
|
操作步骤 |
实验现象 |
结论及化学方程式 |
|
取样于试管中,滴加
|
产生大量的气泡 |
该溶液是 ,反应的化学方程式
|
拓展与应用:确定该溶液还可以选择与小强不同的试剂,你选择的试剂是 (要求类别不同),对应的现象是 。
反思与评价:小淇认为上述探究存在问题,她的理由是 。
Ⅱ.计算:某固体物质由MgSO4和NaOH组成,取24.0g该固体混合物溶于水后,向所得的混合物中逐滴加入质量分数为15%的硫酸溶液(密度为1.1g·mL-1),加入的稀H2SO4的体积x(单位:mL)与所得沉淀质量y(单位:g)有如右下图所示的关系,
求该固体混合物中NaOH、MgSO4的质量各为多少克?(写出计算过程)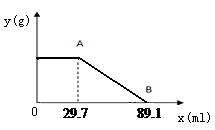
(4)
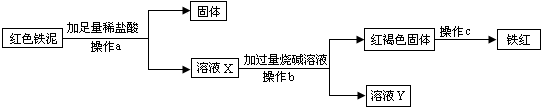
 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O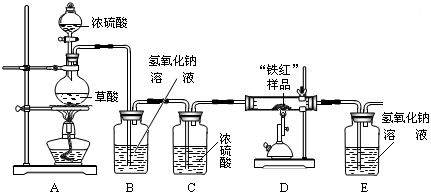
| 甲组数据 | 乙组数据 | ||
| 玻璃管连同样品的质量 | E装置连同药品的质量 | ||
| 实验前 | 试验后 | 实验前 | 试验后 |
| 60g | 57.6g | 100g | 107g |
| 实验步骤 | 实验现象 | 结论 |
①取少量废液于试管中,向其中滴加稀盐酸; ②继续加稀盐酸直到无气体冒出; ③再滴加氯化钡溶液,观察现象 ①取少量废液于试管中,向其中滴加稀盐酸; ②继续加稀盐酸直到无气体冒出; ③再滴加氯化钡溶液,观察现象 |
有气泡冒出 废液中有CO32- 有白色沉淀产生 废液中有SO42- 有气泡冒出 废液中有CO32- 有白色沉淀产生 废液中有SO42- |
废液中有SO42-和CO32- 丙同学的假设成立 |
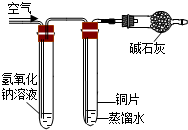
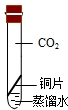
| 实验装置 |  | 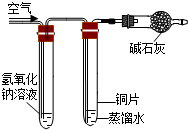 | 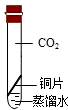 |  |
| 实验现象 | 铜丝不生锈 | 铜丝不生锈 | 铜丝不生锈 | 铜丝生锈且水面附近锈蚀最严重 |
| 实验装置 | 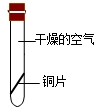 |
 |
 |
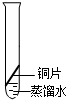 |
| 实验现象 | 铜丝不生锈 | 铜丝不生锈 | 铜丝不生锈 | 铜丝生锈且水面附近锈蚀最严重 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com