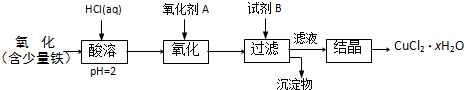
某化工厂以软锰矿、闪锌矿(除主要成分为MnO
2、ZnS外还含有少量的FeS、CuS、Al
2O
3等物质)为原料制取Zn和MnO
2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO
2+FeS+H
2SO
4=MnSO
4+Fe
2(SO
4)
3+S+H
2O
(2)将所得含有Mn
2+、Fe
3+、Cu
2+、Al
3+、Zn
2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO
2和Zn.
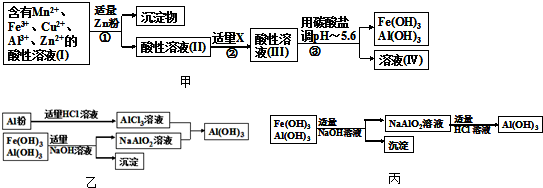
a、操作①中加Zn粉后发生反应的离子方程式为
Zn+Cu2+=Zn2++Cu;Zn+2Fe3+=Zn2++2Fe2+
Zn+Cu2+=Zn2++Cu;Zn+2Fe3+=Zn2++2Fe2+
.
b、操作②中加入适量X的作用是什么
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
;X的首选物的化学式是:
MnO2
MnO2
.
c、操作③中所加碳酸盐的化学式是
MnCO3或ZnCO3或MnCO3和ZnCO3
MnCO3或ZnCO3或MnCO3和ZnCO3
.
(3)为了从上述流程中产生的Fe(OH)
3、Al(OH)
3沉淀混合物中回收Al(OH)
3,工厂设计了如图乙的有关流程图.
a、AlCl
3溶液和NaAlO
2溶液反应生成AI(OH)
3的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3
Al3++3AlO2-+6H2O=4Al(OH)3
.若总共得到n molAl(OH)
3,则消耗的NaOH和HCl的理论量(mol)分别为
、
.
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?
如按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量分别为nmol,大于前流程的消耗量,相对而言,前流程更符合节约的原则
如按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量分别为nmol,大于前流程的消耗量,相对而言,前流程更符合节约的原则
.


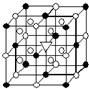 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子