
题目列表(包括答案和解析)
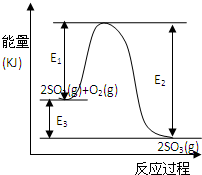 T℃时反应2SO2(g)+O2(g)
T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题.
2SO3(g)过程中的能量变化如图所示,回答下列问题. 2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol
2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol 2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol
2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol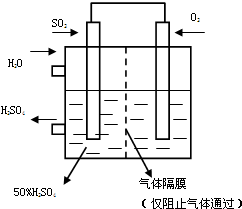
(1)起始时正反应速率是平衡时反应速率的倍数。
(2)在
(3)在温度不变时再向平衡体系中加入2 mol SO2、2 mol O2和4 mol SO3平衡将向哪个方向移动。
(每空2分,共12分)仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
② 将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;
向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: Cl2+2e- =2Cl-
回答问题:
(1)试写出①有关的离子方程式:_________ _______。
(2)请配平②的化学方程式:
KMnO4+ HCl - KCl+ MnCl2+ Cl2↑+ H2O
通过对第②段文字中提供的数据进行推导和计算可得出:
a +b的最大值为 ,a +b最小值为 。
(3)下列四种物质中能使③中的还原过程发生的物质是 。
A. Na2CO3 B. KMnO4 C. XeO3 D. Na2SO3
将该反应的氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥表示电子转移的方向和数目:

(14分) 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+8NH3  7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
(2)已知:反应1:2SO2(g)+O2(g) 2SO3(g) ΔH = —196.6 kJ·mol-1
2SO3(g) ΔH = —196.6 kJ·mol-1
反应2:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
则反3:2NO(g)+O2(g) 2NO2(g)的 ΔH
= _________ kJ·mol-1
2NO2(g)的 ΔH
= _________ kJ·mol-1
(3) 一定条件下,将2molNO与2molO2置于恒容密闭容器中发生上述反应3,下列各项能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
(4)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
|
物质 |
CO |
H2 |
CH3OH |
|
浓度(mol•L—1) |
0.9 |
1.0 |
0.6 |
①混合气体的平均相对分子质量__________________________。
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
(10分)请回答下列问题:
(1)等温、等容下,已知2NO+O2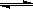 2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是
(填字母)。
2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是
(填字母)。
A.升高温度 B.降低温度 C.加入O2 D.减小压强
E.加入催化剂 F.增加NO的量
(2)若将l.00 molO2和2.00 mol NO混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用O2表示的化学反应速率为 mol•L-1•min-1。
(3)容积均为2 L的四个密闭容器中均进行着(2)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
|
容器编号 |
n(O2) |
n(NO) |
n (NO2) |
v正与v逆的关系 |
|
Ⅰ |
0.20 |
0.10 |
0.20 |
v正=v逆 |
|
Ⅱ |
0.20 |
0.40 |
1.00 |
②v正___v逆? |
|
Ⅲ |
0.60 |
1.20 |
0.80 |
③v正___v逆? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格: ② ③ (填>或 <)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com