
题目列表(包括答案和解析)

 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: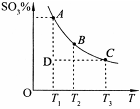
 0(填“>’或“<”)。
0(填“>’或“<”)。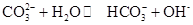 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。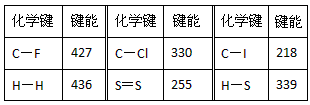
常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数据(KJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C—H | 414 | C—F | 489 | H—F | 565 |
| H-H | 436 | H-N | 391 | F—F | 158 |
(1)根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H= 。
(2)根据键能和反应热化学方程式1/2N2(g)+3/2H2(g) =NH3(g ) △H = —46 kJ·mol-1 则N≡N的键能 。
(12分)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol (理想)气体分子化学键所放出的能量称为键能。下表是一些键能数据(单位为KJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:
_________ <C-Br键能<__________
(2)热化学方程式2H2(g)+S2(g) =2H2S(g);△H= QKJ·mol-1;则Q=
(3) 已知下列热化学方程式:
O2 (g) = O+2(g)+ e— △H1= +1175.7 kJ·mol-1
PtF6(g) + e—= PtF6—(g) △H2=-771.1 kJ·mol-1
O2+PtF6—(s)= O2+(g) + PtF6—(g) △H3= +482.2 kJ·mol-1
则反应O2(g)+ (g)= O2+PtF6— (s)的△H=___________________ kJ·mol-1。
(4)已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:
C(金刚石,s)+O2(g) =CO2(g) △H=-395.4 kJ•mol-1
C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ•mol-1
则石墨转化为金刚石时的热化学方程式为
由此看来碳的这两种同素异形体中更稳定的为 。
(12分)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol (理想)气体分子化学键所放出的能量称为键能。下表是一些键能数据(单位为KJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |

 已知下列热化学方程式:
已知下列热化学方程式: PtF6(g) + e—= PtF6—(g) △H2="-771.1" kJ·mol-1
PtF6(g) + e—= PtF6—(g) △H2="-771.1" kJ·mol-1 O2+PtF6—(s) = O2+(g) + PtF6—(g) △H3=" +482.2" kJ·mol-1
O2+PtF6—(s) = O2+(g) + PtF6—(g) △H3=" +482.2" kJ·mol-1 则反应O2(g) + (g) = O2+PtF6— (s)的△H="___________________" kJ·mol-1。
则反应O2(g) + (g) = O2+PtF6— (s)的△H="___________________" kJ·mol-1。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com