
题目列表(包括答案和解析)
(08年海南化学?14)根据元素周期表1~20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物有___________(填两种化合物的化学式)。
(2)属于稀有气体的是___________(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是____________________。
(4)第三周期中,原子半径最大的是(稀有气体除外)______________。
(5)推测Si、N最简单氢化物的稳定性_________大于_________(填化学式)。
(08年海南化学?1)HBr分子的电子式为
A.![]() B.H+Br- C.
B.H+Br- C.![]() D.H―Br
D.H―Br
(08年海南卷)(10分)A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR'在酸性高锰酸钾溶液中反应生成RCOOH和R'COOH,其中R和R'为烷基)。
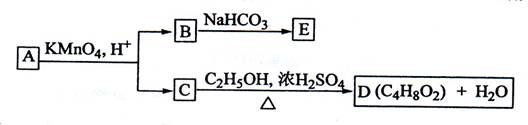
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为_____________;
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是___ 反应类型为_____:
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是__________________
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有__________种,其相应的结构简式是__________________。
(08年海南卷)(11分)A、B、C、D1、D2、E、F、G、H均为有机化合物,请根据下列图示回答问题。
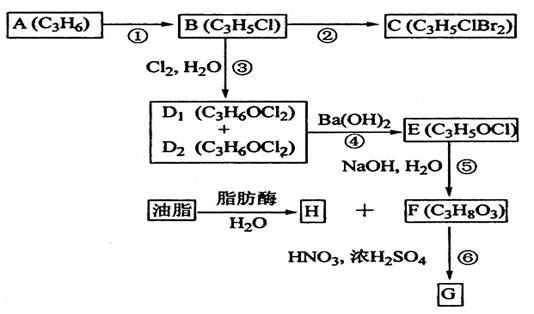
(1)直链有机化合物A的结构简式是_________________________;
(2)①的反应试剂和反应条件是____________________;
(3)③的反应类型是_______________________________;
(4)B生成C的化学方程式是_______________________________;
D1或D2生成E的化学方程式是_____________________________;
(5)G可应用于医疗、爆破等,由F生成G的化学方程式是_____________。
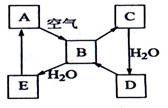
(1)写出A在加热条件下与H2反应的化学方程式____________。
(2)写出E与A的氢化物反应生成A的化学方程式_______________________。
(3)写出一个由D生成B的化学方程式_______________________________;
(4)将5mL0.10mol?L―1的E溶液与10mL0.10 mol?L―1的NaOH溶液混合。
①写出反应的离子方程式________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com